در دهه گذشته پیشرفتهای چشمگیری در زمینه درمان سرطان با استفاده از توسعه پادتنها فراهم شده است. در روشهای رایج درمان سرطان از عوامل سایتوتوکسیک استفاده میشود. این روش، اثرات نامطلوب زیادی روی بیمار داشته و دارو هر دو دسته سلولهای سالم و سرطانی فرد بیمار، را هدف قرار داده و از بین میبرد.
همان طور که قبلا نیز گفته شد، سایتوتوکسیکها اثرات نامطلوب شدیدی روی سلامتی بیمار دارند. اما با ترکیب اثرات کشنده سیتوتوکسیکها و خاصیت انتخابپذیری بالای پادتنها ، میتوان به یک راهکار درمانی مطلوب برای سرطان رسید. پادتنهای متصل شده (Conjugated) با دارو، یکی از این راهکارها است. در این راهکار پادتن، عوامل پادژنی (Antigene) موجود در سطح سلولسرطانی را شناسایی کرده و داروی کانجوگه شده به آن، با اثر سایتوتوکسیکی که دارد، سلول سرطانی را از بین میبرد. به این دسته از داروها، داروهای کانجوگه شده به پادتن (ADC) گفته میشود. در زیر نمایی از یک ADC نشان داده شده است.
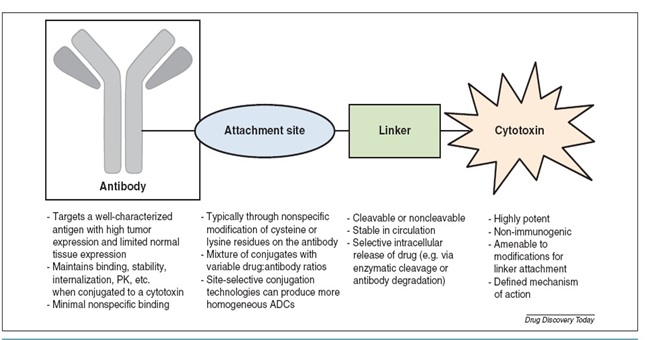 نمایی از اجزای اصلی یک ADC (داروهای کانجوگه شده به پادتن)
نمایی از اجزای اصلی یک ADC (داروهای کانجوگه شده به پادتن)
داروهای متصل شده به پادتن¬ها، حدود یک قرن پیش برای اولین توسط دانشمند و داروساز آلمانی پاول اهرلیچ، پیشنهاد شد، که به صورت یک سامانه دارورسانی کاملا هدفمند و تمایلی، عمل میکند. 50 سال بعد این مفهوم تحت عنوان درمان هدفمند، برای اولین بار و با متصل کردن متوترکسات به پادتنی که پاد ژنهای سطحی سلولهای لوکمیا را هدف قرار میداد، جامه عمل به خود گرفت. پژوهشهای اولیه در این زمینه، روی عوامل هدف گیری موجود، مانند پادتنهای چند دودمانی (Multicolonal antibody) قرار داشت، که در دو حالت اتصال غیرکوالانسی و کوالانسی دارو، بررسی میشد. در سال 1975 توسعه عظیمی در زمینه پادتنهای تک دودمانی موشی توسط کوهلر و میلستین به وجود آمد و همراه با آن، پیشرفتهای عظیمی نیز در زمینه داروهای متصل شده به پادتنها ایجاد شد. تا به حال شرکتهای زیادی در زمینه داروهای ADC سرمایه گذاری کرده اند
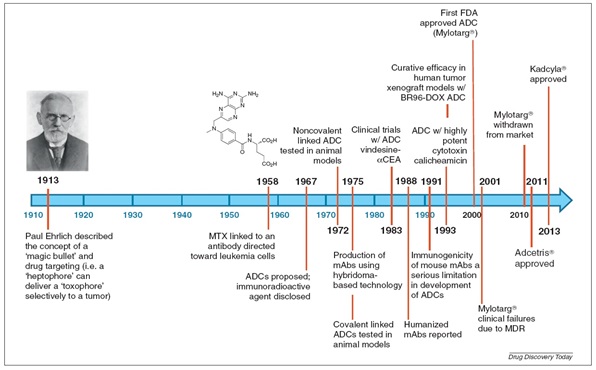
خطوط زمانی تاریخچه تولید پادتنهای کانجوگه شده به دارو
2- ویژگیهای فنی و روشهای تولید
2-1- بهینه سازی عوامل مختلف داروهای ADC
هر داروی ADC از سه بخش پادتن، دارو و اتصال دهنده (Linker) تشکیل شده است. داروهای متصل شده به پادتنها، ویژگی تمایلی بودن پادتن را تحت کنترل درآورده و یک عامل سایتوتوکسیک را به سمت تومور هدایت می¬کنند، در نتیجه بازدهی فعالیت پادتن و دارو افزایش مییابد. از طرف دیگر متصل شدن، توزیع زیستی دارو را تحت تاثیر قرار داده و سلولهای سرطانی را به صورت بهینه و هدفمند در معرض عامل سایتوتوکسیک قرار میدهد و امکان استفاده از عوامل بالقوه را فراهم میسازد.
میزان موفقیت هر داروی ADC به میزان بهینه سازی واحدهای سازنده آن یعنی پادتن، عامل اتصال و دارو بستگی دارد. برای بهینه سازی یک محصول ADC باید متغیرهای زیادی بهینه شود که بعضی از این متغیرها نسبت به انواع تومورها اختصاصی هستند.
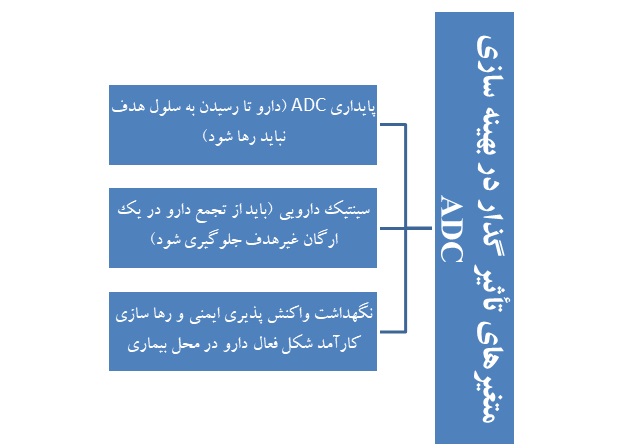 در زمینه توسعه ADC متغیرهای دیگری نیز وجود دارد که عبارتند از:
در زمینه توسعه ADC متغیرهای دیگری نیز وجود دارد که عبارتند از:
- انتخاب پادتن تکدودمانی،
- میزان دارو،
- توانایی و سازوکار رهایش دارو [3].
2-2- پادتنهای تک دودمانی
پادتنهای تک دودمانی منجر به توسعه محصولات دارویی زیستی شده است. چون هدف اصلی داروهای متصل شده رهایش هدفمند دارو به سمت سلولهای سرطانی است، باید از پادتن تک دودمانی که کاملا اختصاصی عمل میکند، استفاده کرد. تا به حال بیش از 20 پادتن تکدودمانی برای استفاده در اهداف تشخیصی مانند شناسایی بیماری سرطان تایید شده و سازوکارهای مختلفی برای استفاده از قابلیت درمانی پادتنهای تک دودمانی وجود دارد. اما اغلب، فعالیت آنها ناپایدار و موقت بوده است.
2-3- پادژن
یکی از عوامل مؤثر در کارآریی داروی متصل شده به پادتن، عامل پادژنی مناسب در تومور سرطانی است. پادژن فوق باید به گونهای باشد که بیان آن در تومور بالا بوده اما به مقدار کم در سلولهای طبیعی یافت شود.
2-4- روش کانجوگه سازی
نحوه اتصال دارو به پادتن یکی از مهمترین عوامل مؤثر در کارایی ADC است. روش متصل سازی ADC، روی ظرفیت استوکیومتری دارو و همگن بودن آن تاثیر گذار است. بنابراین، متصل شدن، نه تنها روی ایفای نقش دارو، بلکه روی میزان فعالیت و پایداری آن نیز اثر گذار خواهد بود.
سه روش متفاوت متصل سازی برای ADC وجود دارد که شامل آلکیلاسیون دیسولفید بین رشتهای کاهش یافته[1]، اسیلاسیون لایزین و آلکیلاسیون سیستئین به صورت ژنتیکی مهندسی شده، است. حدوداً هشت سیستئین بین رشتهای و تا 100 لایزین روی پادتن IgG1 وجود دارد که متصل شدن با آنها منجر به یک مخلوط ناهمگن میشود. متصل سازی با سیستئین محصول همگنتری نسبت به لایزین ایجاد میکند. در حالی که در روشهای نوترکیب که سیستئین کاملا اختصاصی به پادتن اضافه میشود یکنواختی کاملی به وجود میآورد.
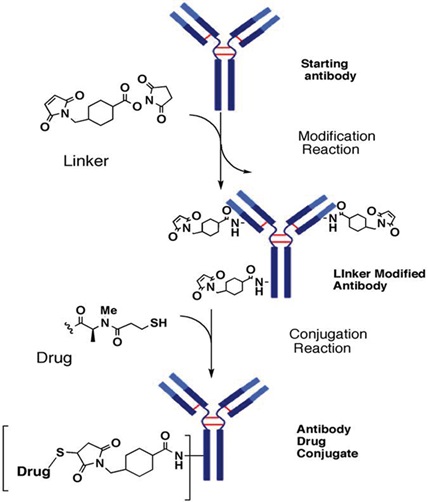 نحوه اتصال دارو به پادتن با استفاده از ماده رابط (Linker)
نحوه اتصال دارو به پادتن با استفاده از ماده رابط (Linker)
————————————————————————————–
[1] Alkylation of reduced interchain disulfides
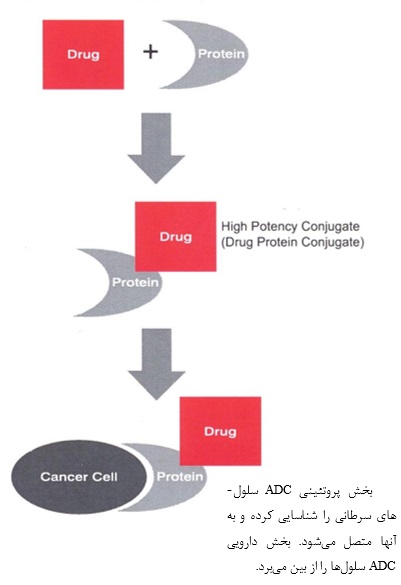
نمایی از فرآیند اتصال داروها به پروتئین
2-5- رهایش دارو
در فرآیند رهایش دارو از ADC ابتدا اتصال دهنده توسط یک پروتئاز شکسته میشود. برای مثال اتصال دهنده دارویی vcMMAE با قابلیت شکست پروتئازی، برای رهایش MMAE در سلولهای هدف طراحی شده است. اتصال دهنده دارویی mcMMAF برای رهایش cys-mcMMAF پس از کاتابولیسم ADC استفاده میشود که به طور مستقیم به آن متصل شده است و از تخریب پروتئازی پادتن برای رها سازی دارو استفاده میکند. پایداری اتصال دهنده دارویی در جریان خون از اهمیت بالایی برخوردار است و زمان نیمه عمر دارو را افزایش داده و شرایط لازم برای دوام دارو را به مدت چند روز بعد از تزریق فراهم میسازد. داروهای به صورت مستقیم متصل شده و اتصال دهندههای با قابلیت شکست پروتئازی از پایداری بیشتری در جریان خون نسبت به هیدرازون و دیسولفیدها برخوردار هستند.
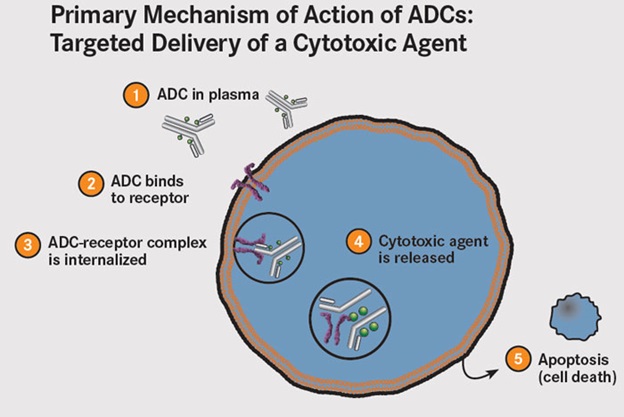 2-6- داروشناسی ADC
2-6- داروشناسی ADC
در حالت ایدهآل ADC در جریان خون غیرفعال است و فقط در صورت اتصال با سلول هدف یا تومور داروی فعال رها میشود. اما با این وجود فقط مقدار اندکی از دارو به بافت هدف میرسد، بنابراین استفاده از یک داروی بسیار قوی از اهمیت بسزایی برخوردار است. بهتر است از داروهای قوی با اثرات سمی بیشتر مانند آریستاتین، مایتانسین و کالیکیامایسین ، برای طراحی ADC استفاده شود.
3- محصولات
اولین آزمایش¬های بالینی انسانی در زمینه داروهای کانجوگه شده به پادتنها، یک دهه بعد روی آنتی میتوتیک وینکا آلکالوئید ویندزین به عنوان عامل سایتوتوکسیک انجام. در جدول 1 و 2 فهرستی از داروهای ADC در مرحله بالینی و پیش بالینی ارایه شده است. پیشرفتهای بیشتر در زمینه مهندسی پادتنها، موجب توسعه پادتنهای تکدودمانی انسانی با حداقل اثرات ایمنیزایی در بدن انسان، در مقایسه با پادتنهای موشی برای تولید داروهای ADC شد. اولین داروی متصل به پادتن با تایید سازمان غذا و داروی آمریکا، داروی Trastuzumab تولید شده در شرکت Genentech است که در تاریخ 22/2/2013 تایید شد. آنها پس از حرکت همراه با جریان خون به سلولهای هدف میرسند و با عوامل پادژنی موجود در سطح آنها پیوند مییابند. سپس عامل سایتوتوکسیک رها شده و به هدف درون سلولی خود میرسد. بنابراین برای تولید یک داروی کارا باید داروی مؤثره، پادتن و اتصال دهنده به خوبی طراحی شوند. (بطور مثال: داروی Kadcyla ، تولید شده توسط شرکت Roche)
جدول-1 فهرستی از داروهای متصل شده به پادتن در مراحل توسعه بالینی
| ADC | دارو | پادتن | نوع سرطان | گروه توسعه دهنده | وضعیت توسعه |
| Gemtuzumab ozogamicin | Calicheamicin | hP67.6/CD33 | AML | Wyeth/Celltech
Group |
تایید FDA |
| CMB-401 | Calicheamicin | hCTMO1/PEM | Ovarian | Wyeth | Phase II completed;
development discontinued |
| CMC-544 | Calicheamicin | G5/44/CD22 | Non-Hodgkin’s lymphoma | Wyeth/Celltech Group | Phase I |
| Cantuzumab mertansine
(huC242- DM1, SB-408075 |
Maytansinoid
DM1 |
huC242/CanAg | Colorectal, pancreatic,
other CanAg+ tumors |
ImmunoGen | Phase I completed |
| BB-10901 (huN901- DM1) | Maytansinoid
DM1 |
huN901/CD56 | SCLC, neuroendocrine
multiple myeloma |
ImmunoGen | Phase I and Phase II
trials in progress |
| MLN2704 | Maytansinoid
DM1 |
hJ591/PSMA | Prostate | Millennium
Pharmaceuticals |
Phase I/II trial in progress |
| Bivatuzumab mertansine | Maytansinoid
DM1 |
Anti-CD44v6 | Head and neck, breast | Boehringer Ingelheim | Phase I initiated Oct 2002;
development discontinued |
| huMy9-6-DM4 (AVE9633 | Maytansinoid
DM4 |
huMy9-6/CD33 | AML | Sanofi-aventis | Phase I initiated
Mar 2005 |
| huC242-DM4 | Maytansinoid
DM4 |
huC242/CanAg | Colorectal, pancreatic,
other CanAg+ tumors |
ImmunoGen | Phase I initiated
June 2005 |
| SGN-15 (BMS-182248,
BR96-dox) |
Doxorubicin | BR96/Lewis [y] | Non-small cell lung | Seattle Genetics | Phase II completed;
development discontinued |
| T-DM1 | Herceptin (trastuzumab) | HER2 | HER2-positive metastatic breast cancer | Genentech/ImmunoGen | FDA Approved |
| MEHD7945A | HER3 | Anti-HER3/EGFR | Head and neck cancer | Genentech/ImmunoGen | Phase II |
| DMUC5754A | monomethyl auristatin E (MMAE) | Anti-MUC16 | Ovarian cancer | Genentech/ImmunoGen | Phase I clinical |
جدول-2 فهرست داروهای متصل شده با پادتن در مراحل توسعه پیش بالینی
| ADC | دارو | پادتن | سرطان | گروه توسعه دهنده |
| hu3S193-calicheamicin
DMH |
Calicheamicin | Hu3S193/Lewis[y] | Colon, gastric, other Lewis[y]-positive tumors | Wyeth |
| Trastuzumab-DM1 | Maytansinoid DM1 | Trastuzumab/HER2/neu | Breast | Genentech/ImmunoGen |
| Trastuzumab-auristatin | Monomethyl auristatin | Trastuzumab/HER2/neu | Breast | Genentech/ Seattle Genetics |
| SGN-35 | Monomethyl auristatin | cAC10/CD30 | Hematologic malignancies | Seattle Genetics |
| SGN-75 | Monomethyl auristatin | Anti-CD70 | Hematologic malignancies, renal | Seattle Genetics |
| CR011-vcMMAE | Monomethyl auristatin E | CR011/CG56972 | Melanoma | Curagen/Seattle Genetics |
4- وضعیت بازار و شرکتهای مهم و پیشگام
در جدول-3 فهرستی از شرکتهای سرمایهگذار در این زمینه ارایه شده است.
جدول-3 فهرست شرکتهای سرمایه گذار در زمینه دارویهای ADC
| شرکت | تکنولوژی | سرمایه گذاری (میلیون دلار) | یادداشت |
| Allozyne | Two platform, one E. coli based, one CHO based, for protein engineering with specific conjugation site | 44 | Lead candidate AZ01, a PEGylated interferon beta-1b for replasing remitting multiple sclerosis is in phase 1b |
| AmbrX | protein engineering with specific conjugation site | 106 | First clinical ADC program likely to start 2013 |
| AnaptyBio | Antibody discovery | 32 | Agreement to create antibodies for Merk and at least one other drug company |
| CytomX Therapeutic | protein engineering and protease – activated antibody therapeutic | 35 | Chief scientific officer is the former director of antibody engineering at Genetech |
| Fabrus | Antibody discovery | 2 | Was first occupant of Pfizer’s La Jolla incubator |
| Igenica | Two plan for antibody discovery | 30 | CEO Mike Rothe was CSO at german antibody firm U3 Pharma |
| Mersana therapeutic | Polymer fleximer backbone and customized linker | 32 | Has preclinical program, looking to partner with antibody company |
| Sutro Biopharma | Extra cellular protein synthesis and site specific conjugation | 60 | Pfizer is the only disclosed Pharma partner |
| Piramal | Antibody production | 2.5 | Upgrade from clinical phase to commercial grade |
| SIGMA-ALDRICH | Commercial HPAPIs | — | —– |
| Genentech | Commercial ADC
(FDA approved) |
190 million Swiss franc | Upgrade from clinical phase to commercial grade |
از جمله شرکت¬های مطرح و پیشرو در این حوزه می¬توان به شرکت Genentech از زیرمجموعه¬های شرکت Roche اشاره کرد. همچنین شرکت¬های دیگری همچون ImmunoGen و Seattle Genetics از دیگر شرکت¬های پیشرو در این حوزه بوده که دارای محصولات مختلفی هستند که در مرحله توسعه است. بررسیهای صورت گرفته نشان میدهد که بازار این دسته از داروها تا سال 2012 نزدیک به 50 میلیون دلار بوده است. بازار خوب پیشروی این دسته از داروها و همچنین کارآیی بالای آنها سبب شده است که شرکتهای بزرگ دارویی سرمایه گذاری خوبی بر روی این فناوری انجام دهند.
جدول-4 میزان سرمایه گذاری شرکتهای داروسازی بر روی فناروی اتصال دارو-پادتن[11]
| شرکت | شرکت همکار در حوزه بیوتکنولوژی | سرمایه گذاری (میلیون دلار) | تاریخ |
| Merck | Ambrx | 303 | Jun-2012 |
| Merck | Endocyte | 1000 | Apr-2012 |
| Abbott Laboratories | Seattle Genetics | 208 | Mar-2012 |
| Endo Pharmaceuticals | Mersana | 270 | Mar-2012 |
| Eli Lilly | ImmunoGen | 200/Drug | Dec-2011 |
| Pfizer | Seattle Genetics | 208 | Jan-2011 |
| Novartis | ImmunoGen | 200/Drug | Oct-2010 |
| Genentech (Roche) | Seattle Genetics | 912 | Aug-2010 |
| Millennium | Seattle Genetics | 290 | Dec-2009 |
| GlaxoSmithKline | Seattle Genetics | 402 | Dec-2009 |
| Amgen | ImmunoGen | 35 | Sep-2009 |
| Byer Healthcare | ImmunoGen | 170.5/Drug | Oct-2008 |
مراجع:
- Rachel S Z, Satarupa B, Ryan P M, (2013), Antibody–drug conjugates, nature reviews. 12: 258-260.
- Heidi L. Perez, Pina M. Cardarelli, Shrikant Deshpande, Sanjeev Gangwar, Gretchen M. Schroeder, Gregory D. Vite and Robert M. Borzilleri, (2013), Antibody–drug conjugates: current status and future directions, Drug Discovery Today. 00(00): 1-13.
- Stephen C A, Nicole M O, Peter D S, (2010), Antibody–drug conjugates: targeted drug delivery for cancer, Current Opinion in Chemical Biology, 14:529–537.
- Alex L, (2011), Antibody-drug conjugates: the next generation of moving parts, www.elsavier.com.
- Giulio C, Dario N, (2012), Antibody–drug conjugates: Basic concepts, examples and future perspectives, Journal of Controlled Release. 161: 422–428.
- John M L, (2005), Drug-conjugated monoclonal antibodies for the treatment of cancer, Current Opinion in Pharmacology. 5:543–549.
- Stephen C A, Kevin E A, (2013), Analytical and bioanalytical technologies for characterizing antibody–drug conjugates, Current Opinion in Chemical Biology. 17: 406–411.
- Pamela A T, Albert B B, (1999), Monoclonal antibody drug conjugates in the treatment of cancer, Current Opinion in Immunology. 11: 584–588.
- Peter D, (2009), Potent antibody drug conjugates for cancer therapy, Current Opinion in Chemical Biology. 13:235–244.
- Ingrid Sassoon and Ve´ ronique Blanc, Antibody–Drug Conjugate (ADC) Clinical Pipeline: A Review, Methods in Molecular Biology. 1045: 1-26.
- http://www.the-scientist.com
—————————————————
ترویج صنعتی فناوری های نانو و میکرو
====================================================================================
(توجه: جهت دسترسی به گزارش نهایی محصولات و شرکتهای دارای گواهی نانومقیاس ستاد توسعه فناوریهای نانو و میکرو به «کتب مرجع محصولات و تجهیزات نانو و صنعت» به نشانی (INDnano.ir/category/book) مراجعه کنید)
همچنین برای دسترسی به فایل PDF کلیه گزارشات، به بخش گزارش های صنعتی پایگاه اینترنتی رسانه تخصصی نانو و صنعت (www.INDnano.ir/category/report) مراجعه نمایید.
====================================================================================