باتری در زبان ساده وسیله ای است که انرژی آزادشده از یک فعلوانفعال شیمیایی را به انرژی الکتریکی تبدیل میکند. باتری امروزه یکی از اجزای مهم ذخیرهساز انرژی در صنعت برق و الکترونیک میباشد و ذخیره انرژی در ظرفیت موردنیاز یکی از پارامترها و چالشهای اساسی است. بهترین گزینه برای رفع این مهم استفاده از باتریهای قابل شارژ جهت ذخیرهسازی انرژی الکتریکی در این تجهیزات میباشد. برای همین منظور استفاده از انواع باتریها، ازجمله باتریهای لیتیومی بسیار حائز اهمیت باشد. باتریهای لیتیومی به دو نوع یونی و پلیمری تقسیم میشوند. باتریهای لیتیوم پلیمر گونه خاصی از باتریهای لیتیم-یون قابل شارژ هستند که نخستین بار از سال ۱۹۹۵ به بازار معرفی شدند.
در حال حاضر یکی از پیشرفتهترین باتریها، باتریهای نوع لیتیوم پلیمر هستند که در تلفن همراه، رایانه، سیستمهای بیسیم همچنین در صنایع هوا – فضا، صنایع دریایی، خودروهای الکتریکی و صنایع خورشیدی مورداستفاده قرار میگیرند. این باتریها تا ولتاژی حدود 7/3 ولت را پشتیبانی میکنند. این باتریها علاوه بر دارا بودن ویژگیهای باتریهای لیتیم-یون، دو ویژگی مهم سبک بودن و شکلپذیری را نیز دارا میباشند. به این معنی که این باتریها را میتوان به هر شکل دلخواه ساخته و مورداستفاده قرار داد. اين باتريها داراي بالاترين انرژي وزني (واتساعت / كيلوگرم)، بالاترين انرژي حجمي (واتساعت / ليتر) بوده و يكي از بهترين ذخيرههاي انواع سيستمهاي باطري الكتروشيميايي هستند [1].
در دهههای قبل، در حوزههای برق و انرژی، از باتریهای بزرگی استفاده میشد که این باتریها بسیار بزرگ و سنگین بوده و درعینحال قابلیت شارژ مجدد را نیز نداشتند. این مسئله باعث میشد که بسیاری صنایع سالانه هزینههای هنگفتی را بهمنظور ساخت و خرید باتریهای جدید بهمنظور جایگزینی با باتریهای استفادهشده متحمل شوند؛ اما نسل بعدی از باتریها که قابلیت شارژ مجدد به آنها اضافهشده بود از دو ماده نیکل و کادمیم برای تأمین انرژی در باتری استفاده میکردند.
این نسل از باتریها قابلیت شارژ مجدد را داشتند اما همچنان وزن زیادی داشته، عملکرد آنها در سرما و گرمای غیرمتعارف، شدیداً کاهش پیدا میکند. نکته دیگر اینکه این دو ماده در کنار هم نوعی ماده سمی را تولید میکنند که نگهداری و درنهایت معدوم کردن باتری را به عملی طولانی و خطرناک بدل میکند. گام بعدی دیگر در این حوزه که بهنوعی انقلابی در صنعت باتریها ایجاد کرد بحث معرفی باتریهای لیتیومی بود. این باتریها که امروزه بهعنوان پیشرفتهترین گونه از باتریهایی که هماکنون در جهان مورداستفاده قرار میگیرند. این باتریها از وزن کمتر و عمر بیشتری نسبت به نمونههای قبلی برخوردار بوده و از عمر بیشتری نیز برخوردار بوده و چون قابلیت شارژ مجدد را نیز دارند از توجیه مناسب اقتصادی نیز برخوردار هستند[1].
بزرگترین محدودیت استفاده از این باتریها قیمت نسبتاً زیاد به همراه احتمال انفجار آنهاست. درواقع در بسیاری از صنایع تنها به دلیل نگرانی مصرفکننده از انفجار این باتریها مصرف آنها محدودشده است. با پیشرفت دانش متالورژی، مهندسان موفق شدند بهجای باتریهای لیتیوم یون، باتریهای لیتیوم پلیمر را تولید و به بازار ارائه کنند. با این دستاورد، بحث انفجار به دلیل جذب رطوبت در این باتریها بهصورت کلی رفع شد.
در گام دوم مهندسان الکترونیک تلاشهای گستردهای را برای محافظت از این باتریها انجام دادند. مشکل عمده محافظت همزمان از ولتاژ، دما و جریان کاری بود که این نوع محافظت در مواقعی که جریانهای چند هزار آمپری و ولتاژهای چند صد ولتی موردنظر باشد، کاری بس دشوار و تا چند وقت بیش غیرممکن بود[2].
1-2 ساختار باتریها
در سادهترین تعریف، باتری ابزاری است که قادر است انرژی شیمیایی را به انرژی الکتریکی تبدیل کند و برعکس. انرژی شیمیایی در انواع الکتریکی از دو الکترود درون باتری ذخیرهشده است. تبدیلات از طریق واکنشهای الکتروشیمیایی کاهش اکسیداسیون یا واکنشهای انتقال شارژ رخ میدهند. این واکنشها شامل تبادل الکترونها بین گونههای الکتریکی در دو الکترود از طریق مدار الکتریکی خارج از باتری است. واکنشها در صفحات الکترود/الکترولیت رخ میدهند.
وقتی جریان در باتری جاری میشود، یک واکنش اکسیداسیون در آند و یک واکنش کاهشی در کاتد رخ میدهد. واکنش اکسیداسیونی الکترونها را به مدار خارجی انتقال میدهد، درحالیکه واکنش کاهشی این الکترونها را از مدار خارجی میگیرد. الکترولیت بهعنوان یک واسط بین الکترودها به کار میرود. این واسطهای برای انتقال یونها پیشنهاد میکند. ازاینرو، جریان جاریشده بهوسیلهی الکترونهای درون الکترودها و یونهای درون الکترولیت تقویت میشود. بهطور خارجی، جریان در میان شارژر یا بار جریان مییابد[3]. واحد الکتروشیمیایی اصلی باتری سلول نامیده میشود، اما کلمهی باتری عموماً برای یک سلول یا برای دو یا چند سلول متصل بهصورت سری/موازی استفاده میشود.
در طول زمان عمر باتری، عملکرد باتری بهطور تدریجی به خاطر تغییرات شیمیایی و فیزیکی غیرقابلبرگشت تمایل به تخریب دارد که با استفاده کردن و باگذشت طول عمرش رخ میدهد تا جایی که باتری نهایتاً غیرقابل استفاده شود. وضعیت سالم بودن باتری شاخصی از نقطهای است که در چرخهی عمر باتری و مقیاسی از وضعیتش نسبت به یک باتری تازه بهدستآمده است. طول عمر باتری فرایند پیچیدهای است که بسیاری از پارامترهای باتری (برای مثال امپدانس و ظرفیت) را در برمیگیرد.
1-3 تاریخچه باتری
اولین بار در سال 1786 گالوانی شیوه جدیدی برای تولید الکتریسیته بهوسیله مواد شیمیایی کشف کرد که بعدها این پیلها به پیلهای گالوانی[1] مشهور شدند. از سال 1800 به بعد پیشرفت زیادی در زمینه باتریها صورت گرفت اما اولین باتریهای قابل شارژ سرب اسید که امروزه نیز در خودروها از آنها استفاده میشود در سال 1859 ساخته شد. تحول بعدی در باتریهای قابل شارژ در سال 1960 با ساخت باتریهای نیکل-کادمیوم[2] رخ داد اما این باتریها نیز در سال 1990 جای خود را به باتریهای جدید نیکل-هیدرید فلز[3] دادند. چرخه پیشرفت باتریهای قابل شارژ با اختراع اولین باتریهای لیتیم-یون در سال 1991 و باتریهای پلیمر-لیتیم یون در سال 1999 کامل گردید. در سالهای اخیر با بهکارگیری نانو ذرات مختلف در این باتریها بازده آنها به مقدار قابلملاحظهای افزایشیافته است. [2].
1-4 کاربردها و پیشرفت فناوری باتری
باتریهای اولیه نامطمئن و ناکارآمد بودند، نوادگان ما ممکن است روزی به فناوری امروزی به روشی یکسان نگاه کنند همانطور که ما امروز تجارب نیاکانمان در 100 سال پیش را ملاحظه میکنیم [4]. این بخش به پیشرفتهایی در ویژگیها و فناوری باتری تمرکز دارد. جدول 1 تاریخچهای از پیشرفتهای باتری را جمعبندی میکند.
جدول 1 – تاریخچه گسترش باتری [4].
| روش | محقق (کشور) | سال |
| اختراع باتری | ولتا[4] | 1800 |
| اختراع باتری سرب-اسید | پلنت[5] (فرانسه) | 1859 |
| اختراع باتری نیکل-کادمیوم | جانگنر[6](سوئد) | 1899 |
| اختراع باتری نیکل-یون | ادیسون[7] (آمریکا) | 1901 |
| اختراع صفحات دوقطبی | آکرمن[8] (آلمان) | 1932 |
| موفقیت در عایقبندی باتری نیکل-کادمیوم | نیومن[9] (فرانسه) | 1947 |
| تولید اولین نمونه تجاری باتری نیکل-هیدرید فلز | سانیو[10] (ژاپن) | 1990 |
| تولید اولین نمونه تجاری باتری لیتیوم-یون | سونی[11] (ژاپن) | 1991 |
1-5 باتری خورشیدی
یک سیستم تولید توان خورشیدی میتواند بهصورت یک سیستم منفصل از شبکه[12] مطابق شکل 1 باشد که در آن انرژی تولیدی توسط پنل خورشیدی، برای تأمین توان یکنواخت در 24 ساعت در سیستم باتری ذخیره میشود.
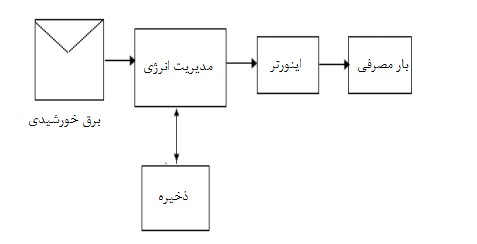 شکل 1 – یک سیستم منفصل از شبکه با باتری]5[
شکل 1 – یک سیستم منفصل از شبکه با باتری]5[
علاوه بر این برای بالا بردن قابلیت اطمینان، میتوان یک سیستم هیبریدی مطابق شکل 2 را انتخاب نمود.
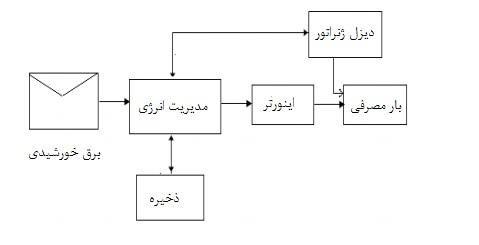 شکل 2 – یک سیستم منفصل از شبکه هیبریدی با باتری]5[
شکل 2 – یک سیستم منفصل از شبکه هیبریدی با باتری]5[
باتری یکی از اجزای اصلی سیستم خورشیدی منفصل از شبکه است که درواقع برق تولیدی توسط پنل خورشیدی را ذخیرهسازی میکند. توان تولیدی ذخیرهشده در باتری خورشیدی برای زمان عدم تابش نور خورشیدی (شب) مورداستفاده قرار میگیرد. برق ذخیرهشده در باتری به کمک اینورتر خورشیدی به برق 220 ولت تبدیل میشود و مورداستفاده تجهیزات قرار میگیرد.
در سیستمهای فتوولتائیک باتریهای یکبارمصرف جایگاهی نداشته و تنها از باتریهای قابل شارژ در این سیستمها استفاده میگردد.
بنا بر توضیحاتی که ارائهشده است، باتریهای زیر در سیستمهای خورشیدی مورداستفاده قرار میگیرند و درواقع دستهبندی کلی باتریهای خورشیدی بر اساس نوع کاربرد عبارت است از:
- باتریهای خورشیدی ثابت (ایستگاهی)
باتریهای سرب اسید[13] با عمق دشارژ بالا برای سیستمهای خورشیدی ثابت و ایستگاهی مورداستفاده قرار میگیرند.
- باتریهای خورشیدی قابلحمل
برای کاربردهای سیستمهای خورشیدی قابلحمل به دلیل وزن کم از باتریهای نیکل-کادمیوم ، نیکل- هیترید فلز ، لیتیوم-یون[14] و یا لیتیوم-پلمیر[15] استفاده میشود.
1-6 پارامترهای عملکردی باتری خورشیدی
1-6-1 عمق دشارژ باتری (DOD[16])
این پارامتر میزان انرژی بیرون کشیده شده از باتری بهعنوان درصدی از ظرفیت کل باتری را نشان میدهد. وضعیت شارژ باتری، اختلاف بین شارژ کامل و DOD باتری است. برای مثال اگر DOD، 25 درصد باشد، وضعیت شارژ باتری 75 درصد است.
1-6-2 سیکل عمر باتری[17]
این پارامتر برابر است با تعداد سیکلهای شارژ و دشارژ باتری قبل از اینکه ظرفیت نامی باتری به کمتر از 80 درصد ظرفیت اولیه خود برسد. بعد از تعداد سیکل عمری مشخصشده، باتری با کاهش ظرفیت کار میکند.
1-6-3 نرخ شارژ و دشارژ (C-Rate)
نسبت ظرفیت باتری به تعداد ساعت کارکرد باتری برای شارژ و دشارژ کامل بهصورت C/X بیان میشود که X زمان شارژ و دشارژ کامل برحسب ساعت است. بهطور مثال اگر X=10H باشد، C-Rate باتری برابر با C/10 است. جریان شارژ و دشارژ باتری، بهصورت تقسیم ظرفیت باتری (AH) بهکل ساعت شارژ و دشارژ باتری است. بهطور مثال برای یک باتری با ظرفیت 50AH، اگر C-Rate برابر با C/10 باشد، جریان شارژ و دشارژ برابر با 5 آمپر میشود.
1-6-4 خود دشارژی[18]
ظرفیت الکتریکی یک باتری در مواقعی که مورداستفاده قرار نمیگیرد، از دست میرود. این کاهش ظرفیت به دلیل واکنش الکتروشیمیایی داخلی باتری است و با افزایش دما، افزایش پیدا میکند. لذا بهتر است، باتری در محیطی با دمای پایین قرار گیرد.
1-7 انواع باتری خورشیدی
1-7-1 باتری سرب اسید
باتریهای سرب اسید رایجترین باتری در سیستمهای فتوولتائیک است که آن را به دودسته زیر تقسیم کرد:
1-7-1-1 باتری سرب اسیدتر(FLA[19])
این باتری معمولی مورداستفاده در سیستمهای ذخیره توان خورشیدی است. باتریهای سرب اسیدتر از دو نوع صفحهای و لولهای هستند. در این نوع باتریها، الکترود بهطور کامل در الکترولیت غوطهوراست. در طول شارژ باتری، گازهای هیدروژن و اکسیژن با توجه به واکنشهای شیمیایی درون باتری از آب تولید میشوند و لذا نیاز بهاضافه کردن دورهای آب به این نوع باتری است.
باتریهای قدیمی که در خودروها مورداستفاده قرار میگرفت از نوع سرب اسیدتر میباشند. در این نوع باتری خورشیدی از محلول آباسید استفاده میشود و مزیت آن قیمت کم این نوع باتری است.
از معایب این نوع از باتریها میتوان به تعمیر و نگهداری مداوم و خطرات احتمالی استفاده از اسید را اشاره کرد همچنین این باتریها هنگام شارژ شدن از خود گازهایی ساطع میکنند که برای سلامتی مضر است و به همین دلیل جهت استفاده در مکانهای پوشیده مناسب نیستند مگر اینکه برای آن تهویه مناسب در نظر گرفته شود.
1-7-1-2 باتری سرب اسید خشک(SLA[20])
این نوع باتری یک الکترولیت را کد دارد. این نوع باتریها، چنین VRLA[21] یا CELA[22] نامیده میشوند.
در این نوع باتریها در طول پروسه شارژ، گازهای هیدروژن و اکسیژن روی صفحات قطبهای مثبت و منفی، از آب تولید میشوند؛ سپس اینکه باهم ترکیبشده و تولید آب میکنند. لذا در این نوع باتریها، اضافه کردن آب نیاز نیست.
باتریهای سرب اسید خشک نیز به دودسته تقسیم میشوند:
1-7-1-2-1 باتری AGM[23]
در این نوع باتری، تودههای شیشه بهصورت فشرده بین صفحات قرار میگیرند. این صفحات شیشهای، الکترولیت را جذب میکنند. مولکولهای اکسیژن از طریق الکترولیت، از صفحات مثبت حرکت کرده و در صفحات منفی با هیدروژن واکنش داده و تولید آب مینمایند.
1-7-1-2-2 باتری ژل[24]
اضافه کردن دیاکسید سیلیکون به الکترولیت یک مایع گرم را شکل میدهد که به باتری اضافه میشود و بعد از خنک کاری بهصورت ژل میشود. هیدروژن و اکسیژن در طول پروسه شارژ، بین صفحات مثبت و منفی حرکت میکنند و این جابهجایی از طریق ترکها و فضاهای خالی در الکترولیت ژلمانند صورت میگیرد.
هردو باتری ژل و AGM نیاز به یک شارژ کنترلشده دارند. در این نوع باتریها عموماً الکترون سرب کلسیم برای کمینه کردن هدر رفت آب و تولید گاز مورداستفاده قرار میگیرند. ولتاژ و جریان هم باید زیر نرخ C/20 باشند. در شکل 3 نمونه یک باتری ژل نمایش دادهشده است.
 شکل 3- نمونه یک باتری ژل ]6[
شکل 3- نمونه یک باتری ژل ]6[
1-7-2 باتریهای نیکل-کادمیوم (Ni-Cd[25])
در باتریهای نیکل-کادمیوم الکترود مثبت از کادمیوم تشکیلشده و الکترود منفی از هیدروکسید نیکل که بهوسیله جداکنندههای نایلون که در الکترولیت هیدروکسید پتاسیم غوطهور هستند از هم جداشدهاند. تعداد سیکل عمری این باتریها در مقایسه با باتریهای سرب اسید بالاتر است و گستره عملکرد دمایی وسیعتری دارند.
تاثیرحافظه[26] پارامتری است که وقتی باتری برای مدت طولانی بلااستفاده باشد کاهش پیدا میکند.
تاثیرحافظه پروسه به یادآوری عمق دشارژ درگذشته است. اگر یک باتری بهطور مکرر تا 25 درصد تخلیه شود، این درصد در حافظه باتری ذخیره میشود و وقتی باتری بیش از 25 درصد تخلیه شود، ولتاژ سل باتری مطابق شکل 4 افت پیدا میکند.
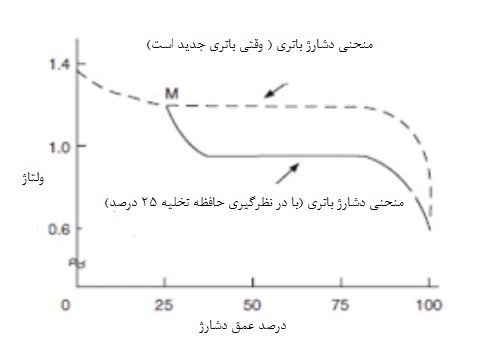 شکل 4- تأثیر حافظه روی عملکرد باتری نیکل-کادمیوم]7[
شکل 4- تأثیر حافظه روی عملکرد باتری نیکل-کادمیوم]7[
1-7-3 باتریهای نیکل-هیدرید فلز (Ni-MH[27])
باتری نیکل-هیدرید فلز نوع توسعهیافته باتری نیکل کادمیوم است. آند بهجای نیکل کادمیوم از هیدرید فلز تشکیلشده است.
1-7-4 باتری لیتیوم-یون
دانسیته انرژی در باتریهای لیتیوم – یون 3 برابر باتریهای سرب اسید است. ولتاژ سل این باتریها معمولاً 3.5 ولت است و ولتاژ موردنظر سیستم خورشیدی با سری کردن این باتریها تأمین میشود.
با بهرهگیری از باتریهای لیتیومی میتوان با بهکارگیری تعداد پیل کمتر به ولتاژ بالاتر دستیافت ]8[ . در شکل (5) نمایی از انواع به اترهای لیتیم-یون مورداستفاده در صنایع مختلف نشان داده میشود.
 شکل 5- انواع مختلف باتریهای لیتیم-یون]8[
شکل 5- انواع مختلف باتریهای لیتیم-یون]8[
1-7-5 باتری لیتیوم پلیمر
در این نوع باتری الکترولیت پلمیر جامد هم بهعنوان الکترولیت و هم بهعنوان جداکننده ایفای نقش میکند واکنش الکترودهای لیتیوم با الکترولیت کمتر است.
باتری لیتیم-پلیمر درواقع نوعی باتری پیشرفته لیتیم-یون است که ازنظر ساختار بسیار شبیه به باتری لیتیم-یون است، البته با برخی تفاوت در ویژگیهای ساختاری که موجب افزایش بهرهوری باتری میشود. بهطور مثال وقتیکه یک باتری لیتیم-پلیمر بهطور کامل شارژ میشود خطر انفجار از بین میرود که این ویژگی میتواند ازنظر ایمنی بسیار حائز اهمیت باشد. در این نوع باتریها در اصل از یک ماده پلاستیکی آند و الکترولیت بر پایه الکترولیت جامد استفاده میشود. فناوری تولید باتریهای لیتیم-پلمیر همواره در حال پیشرفت و بهبود است، بهطوریکه در حال حاضر محققان از الکترولیتی به شکل ژل و جداکننده در این نوع باتریها استفاده میکنند که اطلاعات ویژگیهای آن در حال انتشار است]9[ .
در شکل (6) شماتیکی از ساختار باتریهای لیتیم-پلیمر نشان دادهشده است که در این شماتیک الکترولیت بهعنوان جداکننده الکترودها استفادهشده است. الکترولیتها بهصورت محلولی است که بر پایه ترکیبات پلیمری بوده است]9[ .
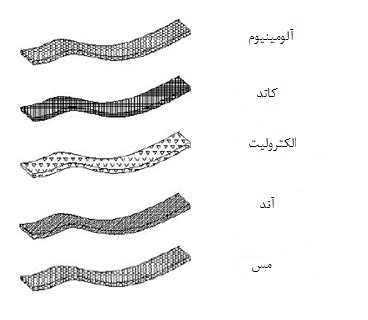 شکل 6- شماتیکی از ساختار باتری لیتیم-پلیمر [9]
شکل 6- شماتیکی از ساختار باتری لیتیم-پلیمر [9]
1-8 تقسیمبندی باتریها بر اساس عمق دشارژ باتری[10]
1-8-1 باتریهای سیکل کمعمق[28]
این نوع باتریها صفحات نازک به همراه سطح بزرگ دارنده جریان زیادی را برای یک مدتزمان کوتاه تأمین میکنند و عمق دشارژ آنها 20 درصد یا کمتر است. ازجمله این باتریها میتوان به باتری سرب اسید مخصوص اتومبیلها اشاره کرد و این نوع باتریها برای سیستم خورشیدی مناسب نیستند.
1-8-2 باتریهای سیکل عمیق (دیپ سایکل[29])
این نوع باتریها صفحات ضخیمتر با سطحهای کوچک دارند و جریان کمی را برای مدت طولانی تأمین میکنند و تا 80 درصد دشارژ میشوند. باتریهای سیکل عمیق مناسب برای سیستمهای خورشیدی هستند.
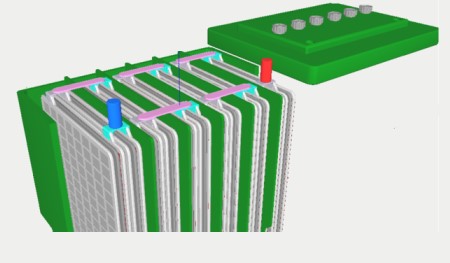 شکل 7- شماتیک یک باتری خورشیدی دیپ سایکل [11]
شکل 7- شماتیک یک باتری خورشیدی دیپ سایکل [11]
- چالشهای موجود در استفاده از باتری خورشیدی و کاربرد نانو فناوری
عملکرد و عمر باتری خورشیدی به پارامترهایی نظیر سیکل شارژ، دمای کاری و میزان دشارژ باتری بستگی دارد ولی قاعدتاً باتریهای خورشیدی باید طوری طراحی شوند که حداقل عمر 3 تا 5 سال را داشته باشند.
در طراحی باتریهای خورشیدی پارامترهای زیر چالش زا هست:
- هزینه سیستم
- راندمان انرژی باتری
- عمر باتری
- تعمیر و نگهداری باتری
- میزان خود دشارژی
- گستره دمایی عملکرد باتری
باتری مورداستفاده در سیستمهای خورشیدی به علت استفاده مداوم و شارژ و دشارژ هرروزه آنها در درجه اول باید دارای طول عمر بالا باشند. طول عمر یک باتری برحسب تعداد سیکل شارژ و دشارژ و میزان سطح دشارژ باتری بیان میشود.
در سیستمهای خورشیدی باتری خورشیدی در طول روز توسط پنل شارژ و در طول شب توسط مصرفکننده دشارژ میشوند. لذا هر شبانهروز یک سیکل شارژ و دشارژ برای باتری محسوب میشود.
در طراحی یک سیستم خورشیدی سطح دشارژ باتری (حداکثر تا سطح دشارژ ۸۰ درصد) باید توسط طراح بهگونهای در نظر گرفته شود که طول عمر باتری بسیار کوتاه نباشد. ویژگی مهم دیگر باتریهای خورشیدی قابلیت دشارژ تا ظرفیت نامی آنها میباشد. در سیستمهای خورشیدی پس از روزهای ابری ممکن است باتری تا عمق ۸۰ درصد دشارژ شود و در این شرایط باتری باید قابلیت تأمین بار را داشته باشد.
در ادامه مشخصههای اصلی باتریهای خورشیدی و مزایا و معایب (چالشهای) آنها را بررسی میکنیم.
با مقایسه باتریهای سرب اسید خشک و سرب اسیدتر، به نتیجه میرسیم که باتریهای سرب اسید خشک مناسبتر هستند.
- حملونقل آسان
- تعمیر و نگهداری کمتر
- عدم نیاز بهاضافه کردن دورهای آب
جدول 2- خلاصه مشخصه های اصلی باتریهای خورشیدی سرب اسید[10]
| 1 | انرژی مخصوص | Wh/Kg35-25 |
| 2 | عمر سیکل کاری | 750-250 |
| 3 | مزایا | هزینه کم، راندان انرژی بالا، عملکرد ساده |
| 4 | معایب | عمر کارکرد نسبتاً کم |
جدول 3 – خلاصه مشخصههای اصلی باتری خورشیدی لیتیومی، نیکل-کادمیوم و نیکل-هیدرید فلز [10]
| لیتیوم- یون | نیکل-هیدرید فلز | نیکل – کادمیوم | باتری |
| 3.6 | 1.2 | 1.2 | متوسط ولتاژ عملکرد (V) |
| 280-200 | 310-160 | 150-90 | چگالی انرژی (Wh/L) |
| 115-90 | 90-50 | 60-30 | انرژی مخصوص (Wh/Kg) |
| 10-1 | 30-20 | 20-10 | نرخ دشارژ خود به خودی در دمای 20 درجه سانتیگراد (درصد در یک ماه) |
| 1000-500 | 600-300 | 700-300 | سیکل کاری |
| 50-20- | 50-20- | 50-20- | رنج دمایی (C°) |
چالشهای موجود در باتریهای خورشیدی را میتوان در موارد زیر خلاصه نمود:
- هزینه بالای باتری خورشیدی
هزینه باتری شامل یک هزینه اولیه و یک هزینه سالیانه است. هزینه اولیه ثابت است که برای خرید اولیه باتریها لازم است.
هزینه دیگر مربوط به هزینههای تعمیر و نگهداری مجموع باتری است که سالیانه در نظر گرفته میشود. عملکرد و عمر باتری، پارامتر مهمی است که در هزینههای سالیانه تأثیرگذار است و اگر عمر باتری کمتر از 3 سال باشد، این هزینه افزایش مییابد و گرانتر شدن سیستم را موجب میشود. با کمک فناوری نانو میتوان عمر کارکرد اجزای باتری را بهبود بخشید و هزینه سالیانه و درنتیجه هزینه کل مجموعه باتری را کاهش داد.
- راندمان انرژی باتری خورشیدی
از آنجائی که باتری خورشیدی یک سیستم ایده آل نیست، بازیابی تمامی انرژی ذخیرهشده در باتری امکانپذیر نیست و قاعدتاً انرژی دشارژ برابر با انرژی شارژ نیست و یک مقدار خود دشارژی در باتری اتفاق میافتد.
راندمان انرژی باتری :
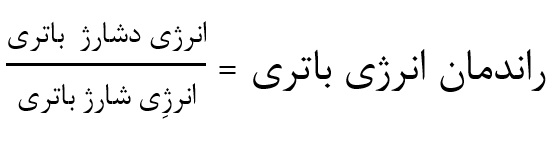
میزان خود دشارژی باتری به افتهای داخلی باتری وابسته است. همچنین خود دشارژ باتری با افزایش دما افزایش پیدا میکند. با فناوری نانو میتوان انرژی دشارژ باتری را به انرژی شارژ باتری نزدیک نمود و در راندمان انرژی باتری خورشیدی را افزایش داد.
- تعمیر و نگهداری باتری خورشیدی
هزینه تعمیر و نگهداری سیستم باتری خورشیدی طی مدتزمان عمر مفید باتری باید، حتیالامکان ناچیز باشد که بتواند بهطور گسترده بهعنوان یک منبع ذخیرهساز مطمئن مورداستفاده قرار گیرد، فناوری نانو با تأثیرگذاری روی پارامترهایی نظیر عمر مفید باتری و قابلیت کارکرد در رنج دمایی گستردهتر، هزینه تعمیر و نگهداری را کاهش خواهد داد.
- فناوری نانو در باتری خورشیدی
تأثیر کوتاهمدت عمده فناوری نانو بر فناوری باتری خورشیدی، از بهکارگیری نانو ذرات حاصل خواهد شد. آنها بدون تأثیرگذاری فوقالعاده بر ظرفیت كل، سرعت شارژ و تخلیه را بهبود میبخشند، نکتهای كه در هنگام مقایسه آنها با پیلهای سوختی باید به خاطر داشت. بااینحال تحقیقات انجامشده روی استفاده از نانولولهها بهجای گرافیت در الكترودها بیانگر توانایی آنها در دو برابر كردن ظرفیت باتری (و حتی بیشتر) است.
محققان ثابت کردهاند كه استفاده از مواد نانوبلوری و نانولولهها در باتری خورشیدی باعث افزایش چشمگیری در طول عمر، دانسیته جریان و سرعت شارژ شدن آنها شده است. نانولولهها بهعنوان جایگزینی مناسب برای گرافیت معمولی در ساختار الكترود گرافیت -لیتیوم در نظر گرفتهشدهاند. به دلیل كوچك بودن ساختار نانولوله سطح مفید تماس آنها با لیتیوم بیشتر از گرانیت معمولی است بهطوریکه ظرفیت یکلایه نانولوله د ر آزمایشگاه به 640 آمپرساعت به كیلوگرم رسیده است. با استفاده از فناوری نانو در ساخت باتریها در ابتدا میزان شارژ مجدد آنها 10 برابر شد كه اكنون با توسعه این فناوری باتریهای کنونی تا 100 برابر باتریهای قبلی (بدون استفاده از فناوری نانو) قابلیت شارژ مجدد را دارند[12].
کاربردهای فناوری نانو در باتری خورشیدی را میتوان بهصورت کلی زیر بیان نمود:
- استفاده از مواد نانو ساختار برای الکترودها و جداکنندههای باتری: از طریق ساختار سازی نانو بهکارگیری نانو کامپوزیتها برای مواد الکترودها و دستگاههای جداکننده و الکترولیت، باتری لیتیوم یون بهینه برای ذخیرهسازی انرژی در سیستمهای فتوولتائیک حاصل میشود[12].
در بین باتریهای خورشیدی، باتریهای لیتیومی مزایای بیشتری دارند و ارتقاء این باتریها با فناوری نانو در اولویت محققان قرارگرفته است. باتریهای لیتیومی در حال نزدیک شده به دانسیته انرژی تئوریک خود هستند. درحالیکه پیشرفتهایی در سیستمهای باتری لیتیوم مثل li-s و li-o2 در حال انجام است، بهکارگیری مواد با ساختار نانو یک ابزار مفید برای بهینهسازی عملکرد سیستمهای باتری است[13].
عموماً باتریهای لیتیوم-یون نسبت به باتریهای سرب-اسید و باتریهای پایه نیکل یک سری مزیت مثل چگالی انرژی بالا و سیکل عمری بالا دارند. هرچند باید محدودیتهایی نظیر ظرفیت مخصوص گرافیت آندی (mAh/gr 372) و اکسید کاتدی (mAh/gr 400-100) را در نظر گرفت[14].
مواد نانو ساختار به دلیل سطح تماس زیاد، تخلخل بسیار موردتوجه صنعت باتریهای لیتیومی قرارگرفتهاند. این مشخصات امکان انجام واکنشهای فعال جدید، کاهش مسیر انتقال یونهای لیتیوم، کاهش سرعت جریان سطح ویژه و بهبود پایداری و ظرفیت ویژه باتریهای جدید را فراهم کرده است. علاوه بر این، مواد نانو کامپوزیتی که برای مسیرهای هادی الکترونی طراحی میشوند، میتوانند مقاومت داخلی باتریهای لیتیومی را کاهش داده، سبب افزایش ظرفیت ویژه، حتی در سرعت جریانهای شارژ/ تخلیه بالا شوند.
نانو مواد بهطور گسترده در علوم زیستی، فناوری اطلاعات، محیطزیست و دیگر زمینههای مرتبط استفاده گستردهای دارند. درواقع نانو مواد در باتریهای لیتیومی بهواسطه الکترودها از توانایی بهبود یافتن تراکم انرژی و قدرت برخوردارند. اخیراً مواد نانو ساختار توجه پژوهشگران برای کاربرد در تجهیزات ذخیره انرژی بهخصوص در انواعی که سرعت جریان شارژ و تخلیه بالایی دارند، مثل باتریهای لیتیومی، جلب کردهاند. این فناوریهای ذخیره انرژی متکی به علوم مواد جدید هستند که بهعنوان نمونه میتوان از توسعه الکترودهایی نام برد که قابلیت شارژ و تخلیه در سرعت جریان بالا را دارند]12[.
باتریهای لیتیومی قابل شارژ شامل یک الکترود مثبت (کاتد)، الکترولیت حاوی یونهای لیتیوم و یک الکترود منفی (آند) هستند . جنس الکترودهای مثبت و منفی اغلب باتریهای تجاری لیتیومی به ترتیب از LiCoO2 و گرافیت است که هر دو بهعنوان جایگاههای تبادل یونهای لیتیوم عمل میکنند. در حین فرایند شارژ کردن باتری، یونهای لیتیوم از الکترود LiCoO2 جدا، همزمان بهوسیله الکترود گرافیت جذبشده و با گرفتن الکترون بار کلی را خنثی نگه میدارند. در حین فرایند تخلیه باتری، یونهای لیتیوم از الکترود منفی خارج و در همان زمانبر روی الکترود مثبت جای میگیرند. این فرایند الکتروشیمیایی، یک واکنش اکسید- احیای حالتجامد است که طی آن، انتقال الکتروشیمیایی بار بین یونهای متحرک و ساختار یک جامد هادی یون و الکترون صورت میگیرد. معمولاً حالت مطلوب آن است که مقدار انرژی ذخیرهشده در واحد جرم یا حجم باتری تا حد ممکن بالا باشد. برای مقایسه محتوای انرژی باتریهای لیتیومی، از پارامتر دانستیه ویژه انرژی (Wh/Kg) استفاده میشود؛ بهطورکلی مزایای بالقوه الکترودهای نانو ساختار برای باتریها را میتوان به شرح زیر خلاصه کرد:
- واکنشهای جدید که امکان انجام آنها با مواد تودهای وجود ندارد؛
- سطح تماس زیاد الکترود- الکترولیت که منجر بهسرعت بیشتر شارژ و تخلیه میشود؛
- مسیر انتقال کوتاهتر الکترونها و یونهای لیتیوم (که امکان عمل در هدایت پایین یونهای لیتیوم و الکترونها یا در توانهای بالاتر را فراهم میکند).
بهطورکلی فرایند شارژ- تخلیه شامل یک واکنش اکسید- احیاست که در آن انتقال یونهای لیتیوم و الکترونها مخصوصاً در شارژ یا تخلیههای سریع نقش مهمی دارند. مواد نانو ساختار میتوانند مسیر انتقال یونها و الکترونها را کوتاه کنند. در مقابل، الکترودهای باتریهای تجاری اغلب از مواد میکرونی مثلاً پودرهای حاوی ذرات میکرونی با سطح ویژه کم تشکیلشدهاند. ازلحاظ نفوذ، این مواد میکرونی به دلیل طولانی بودن مسیر انتقال یونهای لیتیوم و کم بودن سطح تماس بین الکترود و الکترولیت برای فرایندهای شارژ – تخلیه سریع مناسب نیستند. نفوذ یونهای لیتیوم به دلیل ماهیت فاز الکترولیت، سطح مشترک مایع- جامد و پیچوخم مسیر نفوذ یک پدیده پیچیده است و لازم است که اندازه ذرات موردتوجه قرار گیرد. اگر فقط بهکل فرایند توجه کنیم و فرض کنیم که ضریب نفوذ تنها به این عوامل وابسته است، میتوان طول نفوذ را با استفاده از رابطه تعیین کرد که D و T به ترتیب ضریب نفوذ و زمان هستند. ظرفیت ویژه باتری (Q) بهوسیله رابطه Q=IT به دست میآید که I دانسیته جریان ویژه شارژ- تخلیه در واحد A/Kg یا mA/g است. در ظرفیت ثابت، افزایش I منجر به کاهش سریع (T) میشود؛ بنابراین، ظرفیت ویژه مؤثر به نسبت حجم (r3– (r-L) 3) /r3 بستگی دارد که r شعاع ذرات فعال است. برای رسیدن به حداکثر ظرفیت ویژه، طول نفوذ موردنیاز (L) باید از (r) بزرگتر باشد. ذراتی با اندازه r2 باید حدود دو نانومتر باشند. این موضوع نشان میدهد که مواد الکترودی نانو ساختار برای تبدیل و ذخیره دانستیه انرژی و توان بالا ضروریاند.برای اصلاح عملکرد شارژ- تخلیه با سرعت جریان بالا، مسیر انتقال الکترون نیز باید تا حد ممکن کوتاه باشد. از معمولاً کربن دوده بهعنوان یک ماده هادی کمکی در باتریهای لیتیومی استفاده میشد. ولی مشکلاتی نظیر سطح تماس، آلودگی سطح در فرآیند اختلاط مکانیکی مواد هادی کمکی و مواد فعال الکترود وجود داشت؛ بنابراین کاهش مقاومت از طریق کوتاه کردن مسیر انتقال الکترون در فرایند شارژ- تخلیه هنوز مطرح است]13[.
مواد فعال نانوبلوری سنتز شده بر روی نانولولههای کربنی نیز برای باتریهای لیتیومی پرسرعت موردبررسی قرارگرفتهاند و رفتار شارژ- تخلیه اصلاحشدهای را در دانسیته جریان بالا نشان دادهاند]14[. باوجوداین، سنتز مواد فعال نانو ساختار بر روی نانولولهها و نانوسیمهای هادی هنوز یکی از امیدبخشترین زمینههای تحقیقاتی است.
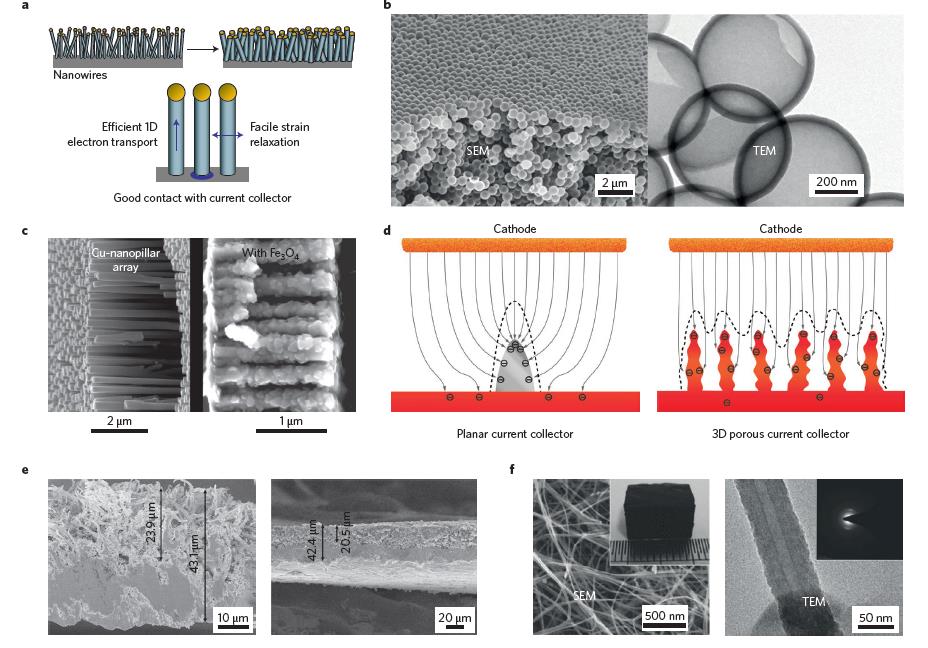 شکل 8- ساخت الکترود ظرفیت بالا با ساختار نانو و نرخ انتقال یونی و الکترونی بالا ]14[
شکل 8- ساخت الکترود ظرفیت بالا با ساختار نانو و نرخ انتقال یونی و الکترونی بالا ]14[
در تحقیق که سان وای و همکاران در سال 2016]12[ انجام دادهاند به بررسی ساخت نانو مواد برای کاربرد در الکترودهای باتریهای لیتیومی پرداختهاند، از شکل 8 مشخص است که با بهکارگیری ساختار نانو، ظرفیت الکترود افزایش پیداکرده و نرخ انتقال یونی و الکترونی نیز بالا رفته است.
بنابراین نیاز داریم که چگالی توان باتری لیتیومی را افزایش دهیم. برای این کار از الکترودهای نانو ساختار استفادهشده است که رسانایی یونی و الکترونیکی بالا، ضریب بهکارگیری بالای مواد و ظرفیت سیکل کاری بالا را نتیجه داده است]15[.
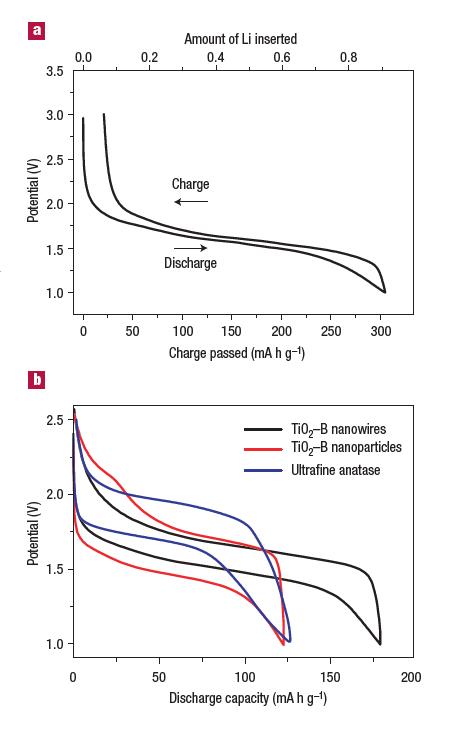 شکل 9- (aمنحنیهای شارژ و دشارژ برای نانو وایرهای LixTiO2-B در نرخ (mA g–1 10)]15[
شکل 9- (aمنحنیهای شارژ و دشارژ برای نانو وایرهای LixTiO2-B در نرخ (mA g–1 10)]15[
(b مقایسه بین رفتار نانو وایر TiO2-B و نانوذره TiO2-B و نانوذره anatase
در شکل 9 منحنی شارژ و دشارژ را برای مواد با ساختار نانو مشاهده میکنیم. از شکل مشخص است که سیکل دشارژ باراندمان انرژی بالا انجامشده است و سیستم قابلیت دشارژ حجم بسیار بالایی از انرژی دریافتی را دارا هست.
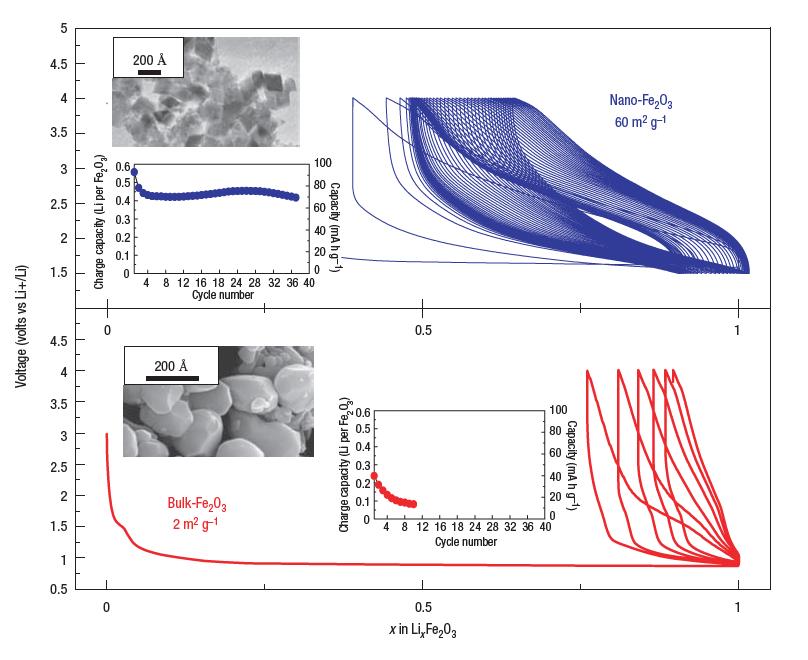 شکل 10- رفتار الکتروشیمیایی نانو ساختار α-Fe2O3 در منحنیهای ولتاژ و سیکل کارکرد[15]
شکل 10- رفتار الکتروشیمیایی نانو ساختار α-Fe2O3 در منحنیهای ولتاژ و سیکل کارکرد[15]
در شکل 10 مشاهده میشود که نانو ساختار α-Fe2O3، افزایش تعداد سیکل کاری باتری را نتیجه داده است.
با کمک فناوری نانو و استفاده از مواد با ساختار نانو، چگالی توان و انرژی باتریها افزایش پیدا خواهد کرد و درعینحال کمترین تأثیر را روی محیطزیست خواهد داشت. بهطور مثال در باتری لیتیوم-سولفور، با کمک فناوری نانو، لیتیوم (آند) و سولفور (کاتد) به ترتیب به چگالی انرژی بالای mAh/gr 3860 و mAh/gr 1672 رسیدهاند. سولفور مادهای است که بهوفور در دسترس است و قیمت کمی دارد و همچنین غیر سمی است. این موارد موجب میشود که li-s با کمک فناوری نانو، در عین راندمان انرژی بالا، تأثیر مخرب کمی روی محیطزیست داشته باشد ]16[.
در مباحث بالا به کاربرد نانو فناوری و استفاده از نانو مواد در بهبود عملکرد اجزای باتری خورشیدی مثل آند و کاتد پرداختیم. یکی دیگر از کاربردهای نانو فناوری، ساخت باتریهای متفاوت خورشیدی مثل نانو باتری است که به آن میپردازیم.
استفاده از فناوری انرژیهای تجدید پذیر خورشیدی، بهطور قابلتوجهی وابسته به توسعه سیستمهای ذخیرهسازی (باتری خورشیدی) کارآمد انرژی است. با ظهور مفهوم شبکه هوشمند[30] که نوعی شبکه برق هوشمند، شامل شبکههای خطوط انتقال، ترانسفورماتورها و … بوده که با استفاده از تجهیزات و فناوریهای دیجیتال و کامپیوتری مدیریت میشود، نانو فناوری بهعنوان یک ابزار قدرتمند قابلحمل مطرحشده است. یک باتری نانویی که قابلیت ذخیرهسازی انرژی کافی را در خود داشته و میتواند انرژی موردنیاز یک سیستم قابلحمل خورشیدی (نظیر اتومبیل خورشیدی) را تأمین کند. نانو فناوری سهمی قابلتوجه در سیستمهای ذخیرهسازی کارآمد انرژی دارد. باتریهای نانویی در پروژهها و کاربردهای مختلف خورشیدی، نظیر وسایط نقلیه الکتریکی (خورشیدی)، شارژر خورشیدی و تأمینکنندههای انرژی پشتیبان در مصارف صنعتی بهجای باتریهای سنتی استفاده میشوند. بهکارگیری فناوری نانو در تولید باتری خورشیدی، مزایای متعددی به همراه دارد که از مهمترین آنها میتوان به کاهش احتمال آتش گرفتن باتری (به دلیل استفاده از مواد الکترودی باقابلیت اشتعال کمتر)، کاهش زمان شارژ و افزایش سطح دسترسی به باتری اشاره نمود. کاهش وزن باتری و افزایش طول عمر مفید آن، از مزیتهای دیگر باتریهای نانویی است که با پوشش سطوح الکترود از طریق نانو ذرات حاصل میشود]17[.
4- محصولات صنعتی
در کشور ایران، با توجه به نوپا بودن صنعت خورشیدی به باتری مخصوص سیستمهای خورشیدی توجه زیادی نشده است ولی تحقیقاتی درزمینه باتریهای لیتیومی خورشیدی انجامشده است. باوجوداین محصول تجاری در زمینه باتریهای خورشیدی با بهکارگیری فناوری نانو تولید نشده است.
پذیرش نانو فناوری از سوی صنعت باتری، تجاریسازی فناوری نانو در باتریهای خورشیدی، روند افزایشی استفاده از باتریهای نانویی در تجهیزات تأمین برق خورشیدی و نیز بهکارگیری نانولولههای کربنی در باتریها برای افزایش کارایی، از مهمترین عوامل رشد بازار نانو باتریها به شمار میرود که البته برخی موارد مانند افزایش قیمتهای جهانی، کاهش رشد اقتصادی و رقابت فناوری، موجب بروز محدودیتهایی در رشد بازار شده است.
در جدول 4 به معرفی برخی از این محصولات پرداختهشده است.
جدول 4- نمونهای از محصولات صنعتی در جهان
نام محصول |
شرکت |
Graphene Based Lithium-ion Battery |
Saint Jean Carbon[18] |
XS Power XS15K Lithium ION Nano technology |
BladeICE[19] |
76.8V5Ah 430WH LiFePo4 Battery |
OptimumNano Energy Co.,Ltd.[20] |
12V Golf Cart LiFePo4 Battery |
OptimumNano Energy Co.,Ltd[21] |
خلاصه مدیریتی
یک سیستم منفصل از شبکه خورشیدی و یا هیبریدی نیازمند ذخیرهسازی انرژی در باتری، در زمان تابش نور خورشید است. این سیستم ذخیرهساز باید قابلیت تأمین توان را در شرایط مختلف محیطی فراهم آورد. با بهرهگیری از فناوری نانو میتوان عملکرد باتریهای خورشیدی را بهبود بخشید. چالشهای اصلی در باتریهای خورشیدی، هزینه بالا، عمر مفید کاری نسبتاً کم و هزینه تعمیر و نگهداری بالا است که با استفاده از مواد نانو ساختار برای الکترودها و جداکنندههای باتری، از طریق بهکارگیری نانو کامپوزیتها برای مواد الکترودها و سیستمهای جداکننده و الکترولیت، باتریهای مخصوص خورشیدی بهخصوص باتری لیتیومی بهینه برای ذخیرهسازی انرژی در سیستمهای فتوولتائیک تولید میشود.
———————————————————-
مراجع:
- Linden, D., Ed. Handbook of Batteries, 2nd Ed; McGraw-Hill: New York, 1995; 3rd ed.; McGraw-Hill: New York, 2001
- Advances in Lithium-ion Batteries (Eds.: W. van Schalkwijk, B.Scrosati), Kluwer Academic/Plenum, New York, 2002.
- Buchmann, Batteries in a Portable World, 2, (2001)
- J. Bergveld, W.S. Kruijt, P.H.L. Notten, Battery Management Systems, Design by Modelling, Philips Research Book Series, 1, Kluwer Academic Publishers, Boston (2002)
- Andreas Jossen, Jurgen Garche and Dirk Uwe Sauer. 2004. Operation conditions of batteries in PV applications. Solar energy, 76(2004) 759-769.
- http://www.newmaxbattery.co.kr
- James P. Dunlop.1997. Batteries and charge control in stand-Alone Photovoltaic Systems Fundamentals and Applications, Florida Energy Center, Cocoa, FL32922- 5703.
- Lithium Batteries Science and Technology (Eds.: G.-A. Nazri, Pistoia), Kluwer Academic/Plenum, Boston, 2004
- Wang, J. Travas-Sejdic, and R. Steiner, “Polymer gel electrolyte supported with microporous polyolefin membranes for lithium ion polymer battery,” Solid State Ionics, vol. 148, pp. 443-449, 2002
- Krebs, ICBR – International Congress for Battery Recycling, Interlaken, June, 2006
- https://www.upsbatterycenter.com/blog/making-deep-cycle-lead-acid-batteries-last/#prettyPhoto/0/
- Use of Nanomaterials in Energy Storage, Fur Mensch & Umwelt, 11.12.2014.
- Zhang, X.; Cheng, X.; Zhang, Q. Nanostructured energy materials for electrochemical energy conversion and storage: A review. J. Energy Chem. 2016, 25, 967–984.
- Sun, Y.; Liu, N.; Cui, Y. Promises and challenges of nanomaterials for lithium-based rechargeable batteries. Nat. Energy 2016, 1, 1607; doi:10.1038/nenergy.2016.71.
- Aricò, A.S.; Bruce, P.; Scrosati, B.; Tarascon, J.M.; van Schalkwijk, W. Nanostructured materials for advanced energy conversion and storage devices. Nat. Mater. 2005, 4, 366–377.
- Nitta, N.; Wu, F.; Lee, J.T.; Yushin, G. Li-ion battery materials: Present and future. Mater. Today 2015, 18, 252–264.
- https://trueindustrynews.com/nano-batteries-market
- https://product.statnano.com/product/8387
- https://product.statnano.com/product/8323
- https://product.statnano.com/product/8318
- https://product.statnano.com/product/8316
————————————————————————————
پانوشت:
[1] Galvanic Cell
[2] Ni-Cd
[3] Nickel-Metal Hydride
[4] Volta
[5] Plante
[6] Jungner
[7] Edison
[8] Ackermann
[9] Neumann
[10] Sanyo
[11] Sony
[12] Off-Grid
[13] Lead-acid battery
[14] Lithium-ion battery
[15] Lithium-polymer battery
[16] Depth Of Discharge
[17] Life Cycle
[18] Self-Discharge
[19] Floaded Lead Acid Battery
[20] Sealed Lead Acid Battey
[21] Valve Regulated Lead Acid Battery
[22] Captive Electrolyte Lead Acid Battery
[23] Absorbed Gas Mat Type Battery
[24] Gel Battery
[25] Nickel-Cadmium
[26] Memory Effect
[27] Nickle-Metal Hydride
[28] Shallow Cycle Battery
[29] Deep Cycle Battery
[30] Smart Grid
———————————————————————
تهیه و تنظیم:
- گروه صنعتی کاربردهای فناوری نانو در صنعت برق و انرژی
بخش ترویج صنعتی ستاد توسعه فناوری های نانو و میکرو
====================================================================================
[جهت دسترسی به گزارش نهایی محصولات و شرکتهای دارای گواهی نانومقیاس ستاد توسعه فناوریهای نانو و میکرو به «کتب مرجع محصولات و تجهیزات نانو و صنعت» به نشانی (INDnano.ir/category/book) مراجعه کنید]
[همچنین برای دانلود فایل PDF کلیه گزارشات بهمراه جزئیات، به بخش گزارش های صنعتی پایگاه اینترنتی رسانه تخصصی نانو و صنعت (www.INDnano.ir/category/report) مراجعه نمایید]
====================================================================================













