سرطان[1] بیماری است که در آن سلولهای بدن به صورت مهارنشدنی به تکثیر میپردازند. این تکثیر سلولها تا جایی ادامه پیدا میکند که بدن از تعادل خارج شده و دچار مشکل میشود. اگر تکثیر سلولها بعد از آن نیز ادامه پیدا کند، میتواند در نهایت منجر به مرگ فرد شود.
توده سلولهای سرطانی با نام تومور[2] شناخته میشود. تومورها به دو صورت خوشخیم و بدخیم هستند. سلول تومورهای بدخیم امکان مهاجرت به دیگر نقاط بدن و آلوده کردن دیگر نقاط بدن را نیز دارند. در اصطلاح به این فرایند متاستاز[3] گفته میشود. زمانی که سلولهای سرطانی متاستاز کنند، دیگر نمیتوان آنها را به صورت فیزیکی و تنها از یک نقطه بدن خارج کرد. در این حالت درمان بیماری بسیار سختتر خواهد شد و برای درمان آن نیاز به درمانهای سیستمی مانند شیمیدرمانی وجود دارد.
سرطان یکی از علل اصلی مرگومیر در سراسر جهان است که آمار مرتبط به آن نیز همچنان در حال رشد است. تنها در سال 2018، 18 میلیون بیمار سرطانی جدید و 5/9 میلیون مرگ مرتبط با سرطان در سراسر جهان به ثبت رسید. پیشبینی میشود که این آمار تا سال 2040 برای بیماران جدید به 30 میلیون و برای مرگومیر به 4/16 میلیون نفر برسد. به طور کلی آمار سرطان در کشورهایی که استاندارد زندگی بالاتری دارند و توسعه یافتهتر هستند، بیشتر است.[1]
ایمنیدرمانی[4] یکی از رویکردهای جدید برای درمان سرطان است. تمرکز اصلی این روش نوین، روی تربیت و ارتقا سیستم ایمنی خود بدن است تا اینکه سیستم ایمنی خود بدن قادر به حذف و از بین بردن سلولهای سرطانی باشد. در این فرایند، نانوذرات توانایی خیلی خوبی از خود نشان دادهاند. در طی این نگاره قصد داریم به کاربردهای نانوکلوئیدهای فلزی در بهبود عملکرد سیستم ایمنی و همچنین درمان سرطان بپردازیم.[2]
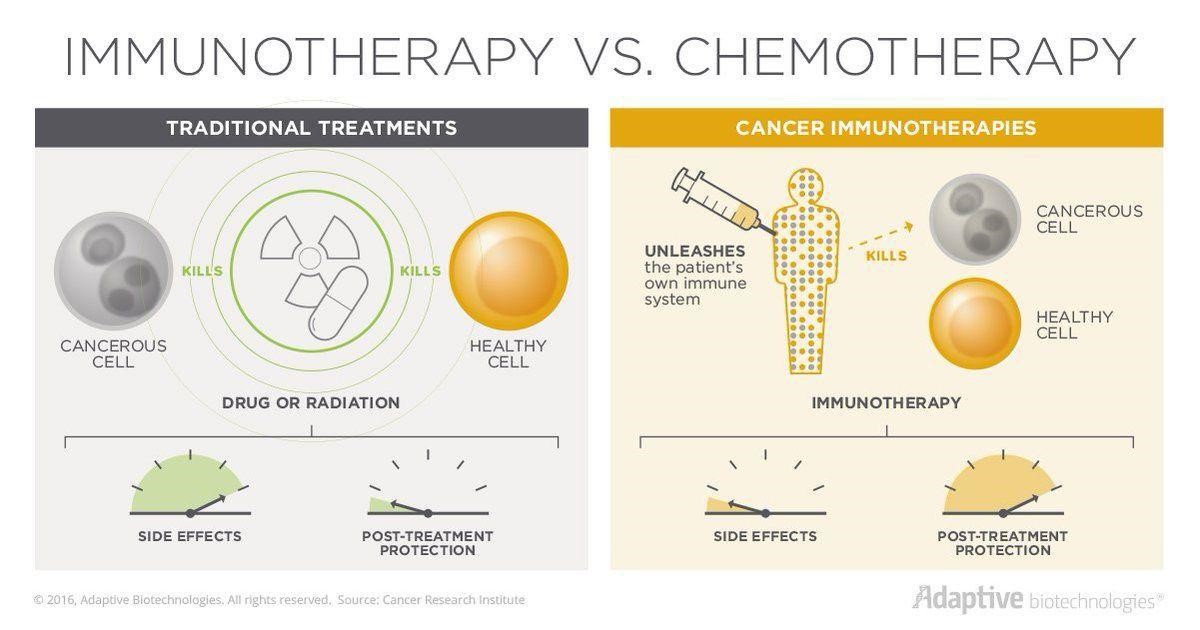 شکل ۱- مقایسه شیمیدرمانی با ایمنیدرمانی[2]
شکل ۱- مقایسه شیمیدرمانی با ایمنیدرمانی[2]
شکل 1 قصد دارد تفاوتهای شیمیدرمانی و ایمنیدرمانی را نشان دهد. در رویکرد شیمیدرمانی، از داروها و مواد شیمیایی استفاده میشود که قابلیت از بین بردن سلولهای سرطانی را دارند. این داروها ممکن است که بعضی سلولهای سالم خود بدن (مانند فولیکول مو) را نیز تحت تأثیر قرار دهند. همچنین پس از اتمام دوره درمان، همچنان شانس بازگشت سرطان وجود دارد؛ اما درباره ایمنیدرمانی، همه موارد گفته شده برعکس است. از آنجایی که در این رویکرد خود سیستم ایمنی بدن انسان سلولهای سرطانی را شناسایی کرده و آنها را از بین میبرد، شانس بازگشت سرطان بعد از درمان خیلی کاهش پیدا خواهد کرد. همچنین احتمال آنکه سیستم ایمنی سلولهای سالم را نیز تحت تأثیر قرار دهد، ضعیف است. [2]
قبل از ورود دقیق به این مبحث، لازم است که بعضی مقدمات مربوط به سیستم ایمنی بدن شرح داده شوند.
آنتیبادی و آنتیژن
سیستم ایمنی بدن انسان سازوکار قدرتمندی برای مبارزه با عوامل عفونی و بیماریزا دارند. این سیستم میتواند عوامل خارجی را در داخل بدن شناسایی کرده و نسبت به نابود کردن آنها اقدام کند.
آنتیژن و آنتیبادیها عواملی هستند که به این شناسایی کمک میکنند. آنتیژنها پروتئینهایی هستند که روی ویروسها، باکتریها، سلولها و… وجود دارند. این آنتیژنها تا حدودی اختصاصی هستند و آنتیژنهای ویروسهای مختلف با یکدیگر متفاوت هستند. سلولهای ایمنی نیز روی بدنه خود پروتئینی به اسم آنتیبادی دارند. آنتیبادی و آنتیژن به مانند قفل و کلید هستند. این بدان معناست که هر آنتیبادی، میتواند به آنتیژن اختصاصی خودش متصل شود.
سلولهای ایمنی از طریق همین آنتیبادیها سلولهای خود بدن را شناخته و میتوانند آنها را از عوامل خارجی تفکیک کنند. زمانی که سلولهای ایمنی آنتیژنهای عوامل عفونی جدید را شناسایی میکنند، اقدام به تولید آنتیبادی آنها کرده و به صورت حافظهدار، زمانی در آینده که مجدداً این آنتیژن در بدن وجود داشته باشد، سلولهای ایمنی از طریق آن آنتیبادیها آنها را شناسایی کرده و اقدام به حذف و مقابله با آنها میکنند.
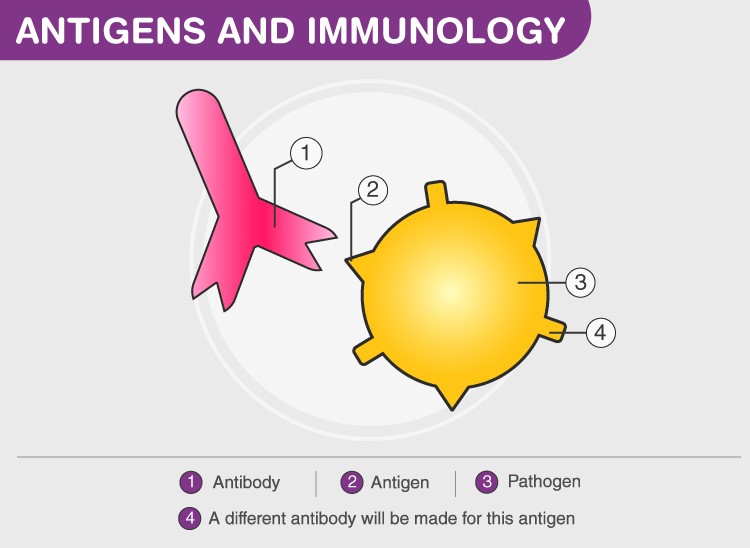 شکل 2- آنتیژن و آنتیبادی و مکانیز عملکرد و اتصال این دو به یکدیگر نشان داده شده است. همچنین زمانی که سیستم ایمنی این پاتوژن (عامل بیماریزا) را شناسایی کند، برای باقی آنتیژنهای آن نیز افدام به تولید آنتیبادی میکند.
شکل 2- آنتیژن و آنتیبادی و مکانیز عملکرد و اتصال این دو به یکدیگر نشان داده شده است. همچنین زمانی که سیستم ایمنی این پاتوژن (عامل بیماریزا) را شناسایی کند، برای باقی آنتیژنهای آن نیز افدام به تولید آنتیبادی میکند.
رهایش[5] مواد زیستی
رهایش مواد بیولوژیک مانند داروها و واکسنها یکی از مسائلی است که امروزه تحقیقات زیادی روی آنها صورت میگیرد. نانومواد قابلیت این را دارند که مواد زیستی مانند داروها را با خود حمل کرده و به سلولهای هدف (در اینجا سلولهای بیمار) برسانند. از این پس به این حوزه علمی با عنوان «رهایش مواد زیستی» اشاره خواهیم کرد. تمرکز این حوزه عمدتاً روی آن است که دارو به صورت پایدار و همچنین به صورت هدفدار رهایش پیدا کند. منظور از رهایش هدفدار دارو این است که دارو تنها اطراف سلولهای بیمار تجمع کرده و به سلولهای سالم خود بدن آسیبی نرساند.
اثر EPR (Enhanced Permeability and Retention)
به طور عادی رگهای بدن، دارای نفوذ خاصی هستند؛ اما در بافتهای سرطانی و بافتهایی که دچار التهاب شدهاند، این نفوذپذیری افزایش پیدا میکند. در نتیجه احتمال تجمع عوامل دارویی در این بافتها بیشتر است. (داروها عمدتاً در خون حمل شده و به بافتهای مختلف بدن انتقال پیدا میکنند) از اثر EPR برای رهایش داروهای ضدسرطان و همچنین دیگر رویکردهای درمان سرطان استفاده زیادی میشود.[3]
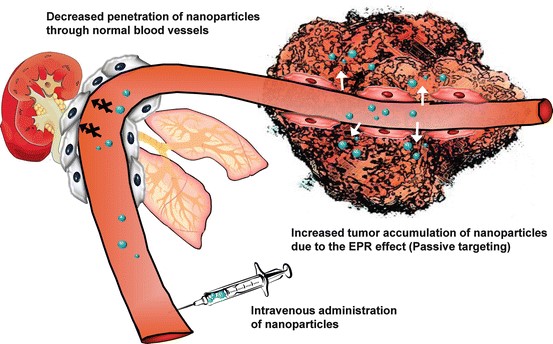 شکل 3- اثر EPR که منجر به افزایش جذب نانوذرات در نواحی تومور میشود.
شکل 3- اثر EPR که منجر به افزایش جذب نانوذرات در نواحی تومور میشود.
ادجوانت[6]
ادجوانتها موادی کمکی هستند که عمدتاً در ساخت واکسنها استفاده میشوند. ادجوانتها پاسخ سیستم ایمنی بدن را به وجود آنتیژنها افزایش میدهند. اضافه کردن ادجوانتها به فرمولاسیون واکسنها، باعث میشود بدن آنتیبادیهای بیشتری را برای آن آنتیژن خاص تولید کند.[4]
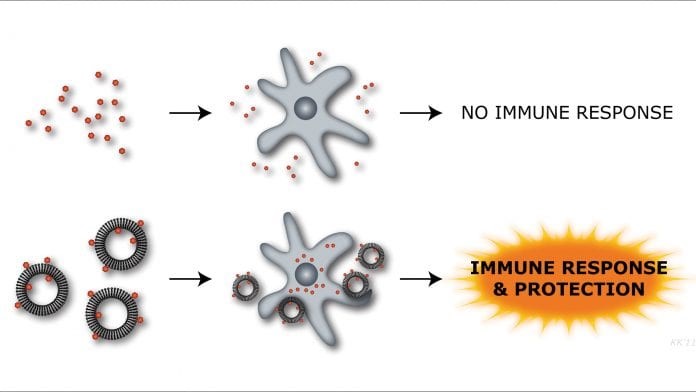 شکل ۴- ادجوانتها باعث افزایش پاسخ سیستم ایمنی بدن میشوند.[4]
شکل ۴- ادجوانتها باعث افزایش پاسخ سیستم ایمنی بدن میشوند.[4]
نانوذرات در ایمنیدرمانی
نانوذرات ویژگیهای منحصربهفرد فیزیکی و شیمیایی زیادی دارند و میتوانند برای بسیاری از کاربردهای درمانی مهندسی شوند. ابعاد آنها معمولاً بین 1 تا 100 نانومتر است که همین موضوع باعث میشود نسبت سطح به حجم بالایی داشته باشند که آنها را برای رهایش و از دید کینتیکی[7] به گزینه مناسبی تبدیل میکنند. همچنین میتوان طراحی این ذرات را بر اساس کاربرد تغییر داد. با تغییر خواصی مانند ابعاد، شکل و بار، میتوان طراحی دلخواه را برای کاربردهای رهایش ایجاد کرد. مطالعات اولیه که روی این حوزه صورت میگرفت، عمدتاً روی رهایش داروهای ضدسرطان بر پایه اثر EPR تمرکز کرده بودند. معمولاً در این رویکردها برای رسیدن بهتر دارو به سلولهای سرطانی، آنتیبادیهای سلولهای سرطانی را به نانوذره متصل میکردند تا با اتصال آنتیبادی به سلول سرطانی، دارو آزاد شده و روی سلول اثر کند. استفاده از آنتیبادیها باعث میشد که احتمال اینکه سلولهای سرطانی هدف گرفته شوند، افزایش یابد.[5]
علت اصلی استفاده از نانوذرات فلزی، دقت در کنترل ابعاد، شکل، بار و اصلاح سطحی آنهاست. در ادامه به رویکردهای موفق در زمینه استفاده از نانوذرات فلزی در ایمنیدرمانی پرداخته خواهد شد.
بهبود رهایش آنتیژنها
یکی از راههای بهبود سیستم ایمنی بدن برای مبارزه با سلولهای سرطانی، این است که بدن به نوعی در برابر سلولهای سرطانی واکسینه شود. تنها لازم است که بدن آنتیژنهای سلول سرطانی (این آنتیژنها برای انواع مختلف سرطان تفاوت هستند) را شناسایی کرده و در نتیجه دفعه بعدی که این سلولها در حال رشد باشند، نسبت به نابود کردن آنها اقدام میکند. در نتیجه اگر به تازگی سرطان درمان شده باشد، میتوان سیستم ایمنی را تربیت کرد تا در صورتی که مجدداً این سلولهای سرطانی در بخش دیگری از بدن دیده شدند، آنها را نابود کند. در حالت عادی این آنتیژنها در بدن تخریب شده و اثرگذاری کمی روی سیستم ایمنی خواهند داشت. اما با استفاده از نانوذرات فلزی، میتوان از آنها در برابر آسیب و تخریب شدن محافظت کرد و همچنین باعث رسیدن مقدار بیشتری از این آنتیژنها به سلولهای ایمنی بدن که نقش شناسایی آنها را دارند شد.
امروزه برای افزایش واکنش ایمنی بدن به آنتیژنها، معمولاً از تجویز همزمان ادجوانت و آنتیژن برای ایجاد واکنش ایمنی شدیدتر استفاده میشود. همین ادجوانتها نیز میتوانند برای رهایش بهتر، از کمک نانوذرات فلزی بهرهمند شوند. اخیراً چندین پژوهش نشان دادهاند که خود نانوذرات فلزی میتوانند نقش یک ادجوانت را ایفا کنند. به عنوان مثال طلا که برای مدت طولانی به عنوان یک ماده زیست خنثی[8] شناخته میشد، میتواند باعث فعال شدن سیستم ایمنی شود و در نتیجه استفاده از آن میتواند ایمنی ضدتومور را افزایش دهد. [5]
همچنین در یک پژوهش نشان داده شده که استفاده از نانوذرات طلا به تنهایی نیز میتواند باعث کاهش رشد تومور شده و از رشد آن ممانعت کند. همچنین نانوذرات نقره نیز اثری مشابه از خود نشان دادهاند و حتی باعث القای فرایند آپوپتوز (مرگ برنامه ریزی شده) در سلولهای سرطانی نیز شدند.[6]
استفاده از خواص اپتیکی نانوفلزات
یکی از ویژگیهای جذابی که نانوذرات فلزی دارند، امکان تحریک آنها و ایجاد حرارت با استفاده از سیگنالهای خارجی مانند فرکانس رادیویی، التراسونیک و پرتوی لیزر یا نور است. این ذرات فلزی با تجمع در نزدیکی سلولهای سرطانی و اعمال سیگنال، میتوانند ایجاد حرارت کرده که در نتیجه این حرارت، سلولهای سرطانی دچار آسیب میشوند. به طور کلی سلولهای سرطانی حساسیت بیشتری نسبت به افزایش حرارت نسبت به سلولهای سالم بدن دارند. چنین روشی باعث افزایش جریان خون در تومورها شده و باعث افزایش سمیت سلولی (برای سلولهای سرطانی) و به طور کلی باعث تغییر در خونرسانی به بافت تومور میشود. در نتیجه این اتفاقات سیستم ایمنی فعال شده و این موضوع باعث کاهش حجم در دیگر تومورها نیز میشود. (یک حالت اثر سیستماتیک دارد و صرفاً به آن منطقه محدود نیست) چنین اتفاقی میتواند به درمان تومورهای متاستاز شده نیز بیانجامد. همچنین شواهدی وجود دارد که استفاده از نانوذرات فلزی به همراه رادیودرمانی، میتواند منجر به ایمنی سیستمی در برابر تومورها شود؛ البته مطالعات بیشتری در این باره نیاز است. [7]
همانطور که گفته شد، راهکار بالا منجر به افزایش جریان خون در بافت سرطانی میشود. این موضوع میتواند باعث افزایش دریافت دارو در شیمیدرمانی شود و اثربخشی شیمیدرمانی را نیز افزایش دهد. در مطالعات مختلف روی تأثیر درمانهای ترکیبی شیمیدرمانی، رادیودرمانی و همچنین استفاده از نانوذرات فلزی مطالعه شده است. نتایج این مطالعات نشان میدهد که استفاده از ترکیب این درمانها با یکدیگر، میتواند اثر درمانی و همچنین عملکرد سیستم ایمنی را افزایش دهد.
هدفگیری سیستم ایمنی اطراف تومور
به طور کلی محیط تومور محیطی خشن برای سلولهای ایمنی است. علت آن نیز اسیدیته بالا و عوامل سرکوبگر سیستم ایمنی هستند. از نانوذرات فلزی میتوان برای رهایش عواملی که فضا را برای فعالیت سلولهای ایمنی مناسب میکنند، در محیط تومور استفاده کرد. در نتیجه مناسب شدن محیط برای حضور سلولهای ایمنی، سلولهای ایمنی قادر خواهند بود که سلولهای سرطانی را شناسایی کرده و آنها را حذف کنند.
به طور کلی در اطراف سلولهای سرطانی فاکتورهایی وجود دارند که با نام فاکتورهای رشد[9] شناخته میشوند. این فاکتورها به رشد سلولهای سرطانی کمک کرده و شرایط را برای آنها مهیا میکنند. تمام سلولهای بدن، فاکتورهای رشد مخصوص خودشان را دارند که در صورت نبود آنها، ممکن است رفتهرفته دچار زوال شوند. یکی دیگر از راههای درمان سرطان، رهایش فاکتورهای رشد مربوط به سیستم ایمنی در محیط تومور است. همچنین به صورت معکوس نیز میتوان این کار را کرد. یعنی از موادی استفاده کرد که شرایط را برای حضور سلولهای سرطانی سختتر کنند و جلوی رشد آنها را بگیرند.[5]
به طور کلی از نانوذرات فلزی میتوان به خوبی برای رهایش هدفمند انواع مواد استفاده کرد.
ارتقای درمانهای برپایه سلول
یکی از رویکردها، استخراج و دستکاری سلولهای ایمنی و در نهایت تزریق مجدد آنها به بدن بیمار است. دو رویکرد برای این موضوع وجود دارد. یکی آنکه سلولهای تولیدکننده سلولهای T (سلولهایی که وظیفه کشتن سلولهای بیمار را دارند) را دستکاری کرده و مجدد به بدن تزریق کنند تا سلولهای T بیشتری تولید کنند و دیگری اینکه خود سلولهای T را کشت داده و با تعداد بیشتر به محل تومور ارسال کنند.
نانوذرات طلا، اکسید آهن و اکسیدروی برای این منظور مورد مطالعه قرار گرفته و نشان داده شده است که باعث افزایش حساسیت سلولهای ایمنی میشوند.
همچنین یکی از مزایای مهم نانوذرات فلزی این است که میتوانند به سامانه قابلیت تصویربرداری را نیز اضافه کنند و در نتیجه با تجمع آنها در نزدیکی تومور، میتوان تصویری از وضعیت تومور و همچنین وضعیت دارو یا مواد تزریقی داشت.
وضعیت پیشرفتهای بالینی
در حال حاضر مطالعات بالینی[10] متعددی روی رویکردهای ایمنیدرمانی با استفاده از نانوذرات فلزی در حال انجام است. تنها یکی از این رویکردها از اجزای سیستم ایمنی استفاده میکند. این محصول Aurimune دارد و با نام QYT-6091 نیز شناخته میشود.[8] این سیستم در واقع نانوذرات طلا با ابعاد 27 نانومتر هستند که با پلیمر PEG[11] (پلیاتیلن گلایکول) و یک پروتئین کشنده پروتئینها (فاکتور نکروز[12] تومور یا TNF[13]) پوشش داده شده است. در سال 2010 این دارو مطالعات فاز یک خود را با 29 بیمار سرطانی به پایان رساند. نتایج این مطالعه بسیار مطلوب بود. اما هنوز اطلاعی درباره فازهای بعدی مطالعات این محصول موجود نیست. هرچند که برنامهریزیهای مطالعات فاز دو برای بیماران دارای سرطان پانکراس صورت گرفته و قرار است از این روش در کنار یک درمان دیگر استفاده شود.
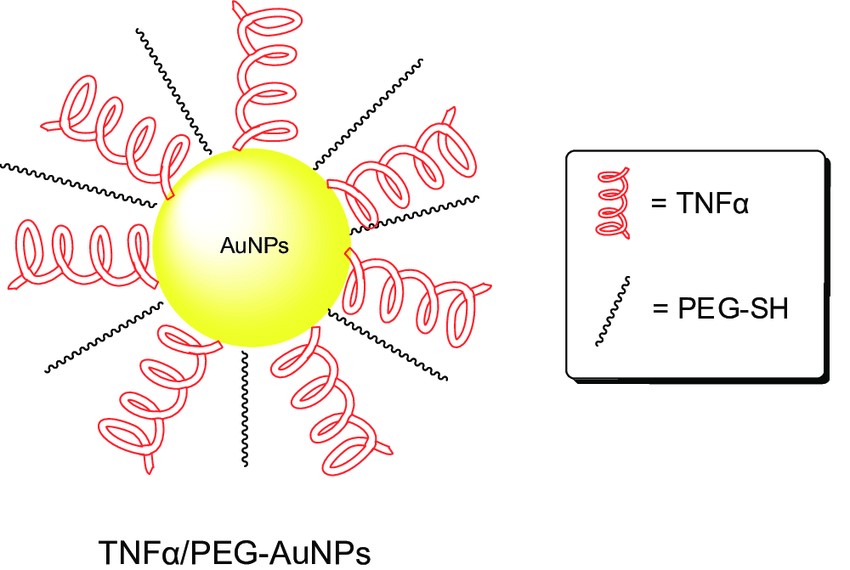 شکل 5- شماتیکی از سامانه Aurimune که در آن هسته از جنس طلا و فاکتور رشد و پلیمر PEG قابل مشاهده هستند. به نوعی یک ساختار هسته-پوسته دارد.
شکل 5- شماتیکی از سامانه Aurimune که در آن هسته از جنس طلا و فاکتور رشد و پلیمر PEG قابل مشاهده هستند. به نوعی یک ساختار هسته-پوسته دارد.
TNF یک سایتوکین[14] شناخته شده است که باعث مرگ سلولهای سرطانی میشود و همچنین نفوذپذیری عروق اطراف تومور را نیز افزایش میدهد.[8]
از دیگر محصولات ساخته شده از نانوذرات فلزی برای درمان سرطان با روشهای ایمنیدرمانی استفاده میکنند، میتوان به NU-0129، Aurolase، Magnablate و NBTXR3 اشاره کرد.[9]
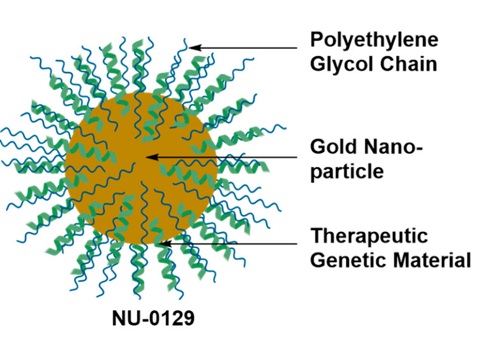
تصویر 6- سامانه NU-0129
NU-0129 نانوذرات کروی طلا هستند که با استفاده از نوکلئیکاسید پوشش داده شدهاند.[10]
Aurolase یک ساختار پوسته و هسته دارد که از سیلیکا-طلا ساخته شده است که با PEG پوشش داده شده است. این ساختار با پرتو لیزر محدوده مادون قرمز تحریک شده و ایجاد حرارت موضعی میکند. اگرچه مطالعه بالینی فاز 1 این محصول در سال 2014 به اتمام رسیده است، نتایج آن هنوز منتشر نشده است.
Magnablate از نانوذرات آهن ساخته شده است. این نانوذرات با قرارگیری در میدان مغناطیسی، باعث افزایش حرارت و نابودسازی تومور میشوند. اگرچه که رویکردهای حرارتی به طور مستقیم ایمنی تراپی نیستند، اما مطالعات نشان داده که آنها منجر به تحریک سیستم ایمنی و افزایش پاسخ ایمنی به سلولهای سرطانی میشوند.[11]
چالشهای در زمینه استفاده از نانوذرات فلزی
نانوذرات فلزی به اندازه مولکولهای آلی که سالهاست مورد استفاده هستند، شناخته شده نیستند و هنوز هیچکدام از درمانهای سرطان بر پایه این مواد و روش ایمنیدرمانی نتوانسته از سازمانهای نظارتی مانند سازمان غذا و داروی آمریکا (FDA)[15] مجوزهای لازم را دریافت کند. همچنین هنوز تعداد کاندیدهای این روش درمانی پایین است و به همین دلیل مقررات خاصی برای آن تعیین نشده است. همین موضوع دریافت مجوزها را از قبل هم سختتر میکند. از طرفی برای استفاده از این مواد، لازم است که تک تک اعضای آن از نظر ایمنی مورد بررسی قرار بگیرد و این موضوع هزینه دریافت مجوز برای این محصولات را افزایش میدهد. این موضوع باعث میشود که بسیاری از شرکتها نتوانند یا برای آنها صرفه نداشته باشد که مطالعات کلینیکی را پیگیری کرده و به انجام برسانند.
مجموعه عوامل بالا و نبود منابع مالی مناسب، باعث شده که پیشرفتهای مربوط به این حوزه برای چند سال درجا زده و با وجود آنکه چندین سال از مطالعات بالینی فاز اول محصولات گذشته است، خبری از مطالعات فاز دوم نباشد و هیچکدام از شرکتها این مطالعات را ادامه ندهند.
هنوز اطلاعات کافی درباره برخی نانوذرات فلزی، سمیت آنها و فرایند دفع آنها از بدن وجود ندارد و چگونگی نحوه دقیق تعامل این فلزات با سیستم ایمنی بدن همچنان ناشناخته است.
————————————————–
نتیجهگیری
نانوذرات فلزی توانستهاند تا به اینجای کار، پتانسیل خوبی برای کار روی سرطان و ایمنیدرمانی از خودشان نشان بدهند. کاربرد آنها در ایمنیدرمانی میتواند از رهایش عوامل مختلف گرفته تا ایجاد حرارت که باعث رهایش آنتیژن توسط تومورها شود، ادامه داشته باشد. اما به دلیل آنکه هنوز قوانین مشخصی برای استفاده از این فلزات در درمان سرطان نیست، امکان طراحی مطالعات بالینی و دریافت مجوز فرایندی بسیار سخت، طولانی و هزینهبر است که بسیاری از شرکتها از آن سر باز میزنند. جدای از این موارد، همچنان لازم است که مطالعات بیشتری بر روی سازوکار دقیق تأثیر این فلزات روی سیستم ایمنی صورت بگیرد.
————————————————–
منابع
[1] World Health Organization, “Global Cancer Observatory.” https://gco.iarc.fr/ (accessed Oct. 11, 2021).
[2] D. Yetman and L. Castiello, “Immunotherapy vs. Chemotherapy,” Health line, 2021. https://www.healthline.com/health/cancer/immunotherapy-vs-chemotherapy (accessed Oct. 11, 2021).
[3] J. Y. Yhee, S. Son, S. Son, M. K. Joo, and I. C. Kwon, “The EPR Effect in Cancer Therapy,” in Cancer Targeted Drug Delivery, New York, NY: Springer New York, 2013, pp. 621–632.
[4] D. Christensen, “Vaccine adjuvants – an essential constituent in modern vaccines!,” Health Europa, 2019. https://www.healtheuropa.eu/vaccine-adjuvants/90417/ (accessed Oct. 11, 2021).
[5] E. R. Evans, P. Bugga, V. Asthana, and R. Drezek, “Metallic nanoparticles for cancer immunotherapy,” Mater. Today, vol. 21, no. 6, pp. 673–685, 2018, doi: 10.1016/j.mattod.2017.11.022.
[6] R. R. Arvizo, S. Bhattacharyya, R. A. Kudgus, K. Giri, R. Bhattacharya, and P. Mukherjee, “Intrinsic therapeutic applications of noble metal nanoparticles: past, present and future,” Chem. Soc. Rev., vol. 41, no. 7, p. 2943, 2012, doi: 10.1039/c2cs15355f.
[7] M. A. Miller, “Gold photothermal therapy: A positive for negative margins,” Sci. Transl. Med., vol. 10, no. 423, p. eaar7512, Jan. 2018, doi: 10.1126/scitranslmed.aar7512.
[8] “TNF-Bound Colloidal Gold in Treating Patients With Advanced Solid Tumors,” Clinical Trials, 2012. https://clinicaltrials.gov/ct2/show/study/NCT00356980.
[9] S. Bonvalot et al., “NBTXR3, a first-in-class radioenhancer hafnium oxide nanoparticle, plus radiotherapy versus radiotherapy alone in patients with locally advanced soft-tissue sarcoma (Act.In.Sarc): a multicentre, phase 2–3, randomised, controlled trial,” Lancet Oncol., vol. 20, no. 8, pp. 1148–1159, Aug. 2019, doi: 10.1016/S1470-2045(19)30326-2.
[10] P. Kumthekar et al., “A phase 0 first-in-human study using NU-0129: A gold base spherical nucleic acid (SNA) nanoconjugate targeting BCL2L12 in recurrent glioblastoma patients.,” J. Clin. Oncol., vol. 37, no. 15_suppl, pp. 3012–3012, May 2019, doi: 10.1200/JCO.2019.37.15_suppl.3012.
[11] N. V. S. Vallabani, S. Singh, and A. S. Karakoti, “Magnetic Nanoparticles: Current Trends and Future Aspects in Diagnostics and Nanomedicine,” Curr. Drug Metab., vol. 20, no. 6, pp. 457–472, Jul. 2019, doi: 10.2174/1389200220666181122124458.
———————————————-
[1] Cancer
[2] Tumor
[3] Metastasis
[4] Immunotherapy
[5] Delivery
[6] Adjuvant
[7] Kinetics
[8] Bioinert
[9] Growth Factors
[10] Clinical Trials
[11] Poly Ethylene Glycol
[12] Necrosis
[13] Tumor Necrosis Factor
[14] Cytokine
[15] Food and Drug Administration
———————————————————————
بخش ترویج صنعتی فناوری های نانو و میکرو
====================================================================================
[جهت دسترسی به گزارش نهایی محصولات و شرکتهای دارای گواهی نانومقیاس ستاد توسعه فناوریهای نانو و میکرو به «کتب مرجع محصولات و تجهیزات نانو و صنعت» به نشانی (INDnano.ir/category/book) مراجعه کنید]
[همچنین برای دسترسی به فایل PDF کلیه گزارشات بهمراه جزئیات، به بخش گزارش های صنعتی پایگاه اینترنتی رسانه تخصصی نانو و صنعت (www.INDnano.ir/category/report) مراجعه نمایید.]
====================================================================================
65204M21













