فرمولاسیون نانودارو به انتخاب سیستم پلیمری مناسب با بیشترین امکان کپسولاسیون (بازده بالای کپسولاسیون)، ارتقاء زیستدسترسپذیری[1] و زمان نگهداری، بستگی دارد. از پلیمرهای طبیعی و سنتزی مختلفی جهت کپسوله کردن و دارورسانی استفاده میشود که باید تمام ویژگی زیستی را فراهم سازد. پلیلاکتیک-کو-گلیکولیکاسید (PLGA)[2] یکی از توسعهیافتهترین پلیمرهای زیستسازگار و زیستتخریبپذیر[3] از خانواده پلیاسترهای آلیفاتیک است و به خاطر خواص جذابش به یک انتخاب محبوب در برنامههای کاربردی دارورسانی تبدیل شده است. هیدرولیز و تخریب PLGAدر محیط آبی به آرامی منجر به تولید مونومرهای متابولیتی لاکتیکاسید و گلیکولیکاسید میشود (شکل١). دو مونومر درونزاد[4] بوده و به راحتی توسط بدن متابولیزه میشوند، بنابراین PLGA کمترین سمیت سیستماتیک در کاربردهای دارورسانی یا زیستپزشکی را دارد. PLGA برای طراحی و استفاده نانوذرات به عنوان سیستمهای دارورسان در زمینههای مختلف زیستپزشکی مثل واکسیناسیون، التهاب و تصویربرداری در انسان، دارای تاییدیه از سازمان غذا و داروی آمریکا[5] و آژانس پزشکی اروپا [6] است که میتوان به تاییدیه این دو سازمان برای استفاده از PLGA در بخیههای قابل جذب در انسان اشاره کرد. این پلیمرها به صورت تجاری با جرم مولکولی و ترکیبات کوپلیمری مختلف موجود هستند و زمان تخریب آنها برحسب جرم مولکولی و کوپلیمریزاسیون، میتواند بین چندین ماه تا چندین سال به طول بیانجامد.
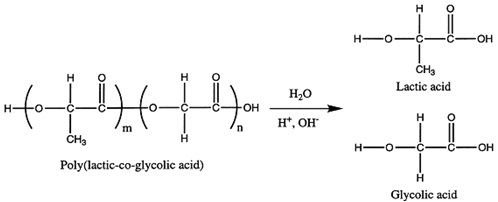 شکل١. هیدرولیز PLGA
شکل١. هیدرولیز PLGA
 شکل2. نانوذرات PLGA به همراه ویتامین E-TPGS
شکل2. نانوذرات PLGA به همراه ویتامین E-TPGS
2- تهیه و کپسولاسیون داروها در نانوذرات پلیمری
نانوذرات پلیمری، بر اساس نوع کاربرد و نوع داروی کپسوله شده، با روشهای گوناگونی تهیه میشوند. این نانوذرات ویژگی رهاسازی کنترل شده و ممتد را دارند، اندازهای در ابعاد سلولی داشته و با بافت و سلولها، زیستسازگاری دارند. بعلاوه، نانوداروها در خون پایدار و غیرسمی بوده و از مضراتی چون: لخته کردن خون، تحریک سیستم ایمنی، التهابزایی و فعال کردن نوتروفیلها عاری هستند. این ذرات برای حمل انواع مولکولهای دارویی، پروتئینی، پپتیدی یا نوکلوئیکاسیدی، مناسب هستند. همچنین، استفاده از پلیمرها در درمان هدفمند تومورها به عنوان حامل دارویی افزایش یافته که میتوان دلیل آن را در افزایش نیمهعمر دارو، افزایش اثربخشی در محل هدف و جلوگیری از آسیبها و عوارض جانبی به دیگر سلولها دانست. روش عمومی تهیه و کپسولاسیون نانوداروهای زیستتخریبپذیر در شکل3 نشان داده شده است.
داروهای آبگریز و آبدوست از طریق امولسیون آب – روغن در ذرات PLGA در مقیاس میکرو و نانو کپسوله میشوند. PLGA در فاز آلی حل شده و داروی آبگریز به طور مستقیم به فاز آلی اضافه شده و با یک سورفاکتانت و یا تثبیتکننده در آب امولسیون میشود. ولی داروی آبدوست ممکن است با محلول پلیمری قبل از تشکیل ذرات، امولسیون شود. انفجار فراصوت با شدت بالا تشکیل قطرات ریز پلیمری را آسان میکند. امولسیون به دست آمده به فاز آبی بزرگتر اضافه شده و برای چندین ساعت همزده میشود تا اجازه تبخیر به حلال آلی داده شود. نانوذرات سخت شده، شسته شده و به وسیلهی سانتریفیوژ جمعآوری شده و برای ذخیرهسازی طولانی مدت در لولههای خلا منجمد میشوند (شکل3).
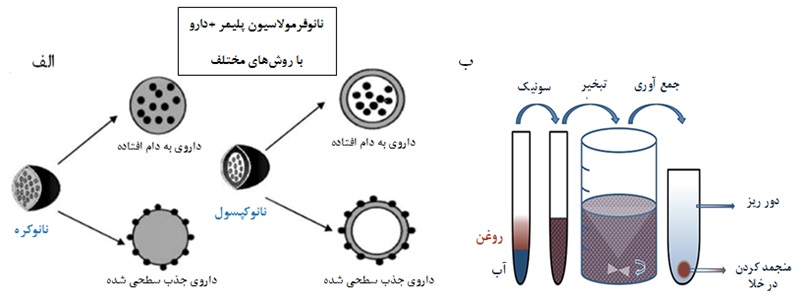 شکل3. نمایش شماتیک الف) ساختارهای نانوکپسول و نانوکره، نانوذرات زیستتخریبپذیر پلیمری مورد استفاده برای دارورسانی هدفمند ب) مراحل تولید نانوذرات PLGA به همراه دارو
شکل3. نمایش شماتیک الف) ساختارهای نانوکپسول و نانوکره، نانوذرات زیستتخریبپذیر پلیمری مورد استفاده برای دارورسانی هدفمند ب) مراحل تولید نانوذرات PLGA به همراه دارو
———————————————
[1]Bioavailability
[2]Poly lactic-co-glycolic acid (PLGA)
[3]Biodegradable
[4]Endogenous
[5]Food and Drug Administration (FDA or USFDA)
[6]European Medicine Agency (EMA)
3- اصلاح سطح
بارهای سطحی نانوذرات تاثیر مهمی برجذب و برهمکنش آنها با سلولها دارد. نانوذرات با بارهای مثبت به دلیل برهمکنشهای موجود بین ذرات باردار مثبت و غشاهای سلولی با بار منفی، مقدار ورود بیشتری را نشان میدهند. نانوذرات PLGA دارای بار منفی هستند و میتوانند با اصلاح سطح به بارهای خنثی یا مثبت تغییر بار دهند. همچنین میتوان با اصلاح سطحی، هدف قرار دادن تومورها یا اندامها را با اتصال گزینشی سلولی و ورود از طریق گیرندههای آندوسیتوز[1] افزایش داد. اغلب لیگاندهای هدف از طریق اتصالات زنجیرههای پلیاتیلنگلیکول (PEG)[2] به سطح نانوذرات پیوند میخورند (شکل4). لازم است که لیگاندها به طور مناسبی به نانوذرات متصل شوند تا بتوانند تمایل خود را برای اتصال به گیرندهها حفظ کنند. باید به این نکته اشاره کرد که اصلاح سطحی نانوذرات برای شناسایی نشدن ذرات توسط سامانه شبکه پوششی داخلی[3] انجام میگیرد. نانوذرات میتوانند با مولکولهایی پوشیده شوند که با ایجاد لایهای آبدوست در سطح، موجب پنهان شدن سطوح آبگریز شوند.
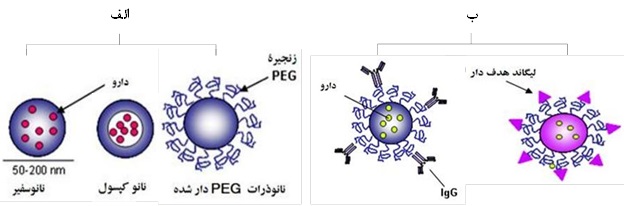
شکل 4. الف) پگیله کردن[4] نانو ذرات ب) نانو ذرات هدفدار
————————————
[1]Receptor Endocytosis
[2]Polyethylene glycol (PEG)
[3]Reticuloendothelial (RES)
[4]PEGylation
4- کاربردهای PLGA در فرآیندهای دارورسانی هدفمند
پلیمر PLGA در فرآیندهای مختلف دارورسانی و زیستپزشکی مورد استفاده قرار میگیرد. جدول 1 به برخی از فرآیندهای که از این پلیمر استفاده شده است، میپردازد.
جدول1. کاربرد پلیمر PLGA در فرآیندهای دارورسانی
فرآیند دارورسانی هدفمند |
توضیح |
ویژگی فرآیند و مزایای استفاده از PLGA |
مورد استفاده PLGA |
|
فتودینامیک درمانی (PDT)[1] |
استفاده از داروی حساس به نور (یک فتوسنتیسایزر[2])، به همراه نور با طول موج مرئی به منظور تخریب سلولهای هدف (سلولهای تومور)، استفاده برای معالجه سرطان بخصوص برای معالجه تومورهای سطحی |
* وابستگی موثر بودن درمان به اندازه نانوذرات برای جذب توسط سلول و بافت هدف* استفاده از نانوذرات PLGA به دلیل مکانیزم ساده، بارگذاری بالای دارو ، احتمال کنترل آزادسازی دارو و روشهای سنتز آنها |
ایجاد یک سیستم دارورسانی قابل استریل برای وِرتوپورین که یک حساسکنندهی مناسب برای درمان چندین نوع سرطان از جمله پوست با استفاده از نانوذرات PLGA است. |
|
تولید نانوذرات PLGA به همراه هایپرسین[3] و ایندوسیانین سبز (ICG)[4] برای ایجاد کنتراست در روشهای تشخیصی سرطانهای سطحی از جمله پستان و پوست |
||||
نانوذرات مغناطیسی (MNP)[5] در تصویربرداری پزشکی |
استفاده در کاربردهای زیستپزشکی به دلیل زیستسازگاری، سهولت اصلاح سطح و خواص مغناطیسی، کاربردهای تشخیصی و درمانی در بیماری سرطان، بیماریهای قلبی و عصبی |
ویژگیهای مورد نیاز برای نانوذرات در تصویربرداری: یکنواختی سوپرپارامغناطیسی،پایداری کلوییدی بالا در شرایط فیزیولوژیک ،سمیت پایین و زیستسازگاری بالا،قابلیت عملکردی شدن برای اتصال به گونههای فعال زیستی مثل پروتئین و نوکلئیکاسید |
استفاده از پوشش پلیمری PLGA زیستسازگار تایید شده توسط سازمان غذا و دارو برای استفاده درSPIO 6 |
|
انتقالدهندههای ژنی غیرویروسی نانوذرات برای انتقال ژن و دارو |
ژندرمانی، روشی بالقوه برای درمان ناهنجاریهای ژنتیکی و سایر بدخیمیها با استفاده از پلاسمید DNA برای بیان پروتئین درمانی خاص و یا الیگونوکلوتیدهایی[6] برای خاموش کردن ژن ایجادکننده بیماری |
به سبب اهمیت اصلی پلاسمید DNA خالص برای تولید واکسن و به علت تخریب DNA به وسیلهی نوکلئازهای سرم، استفاده از DNA خالص برای انتقال مواد ژنتیکی در شرایط درون تن مناسب نیست. در این شرایط از یک سیستم حامل زیستسازگار برای حفاظت DNA در مقابل عوامل سامانه شبکه پوششی داخلی و انتقال آن به سلول هدف استفاده میشود. |
سنتز PLGA به روش تبخیر حلال امولسیون، استفاده از پلیوینیلالکل به عنوان پایدارکننده و جداسازی ذرات با استفاده از غشاهای دیالیز میباشد.ذرات کوچکتر 27 برابر ذرات بزرگتر در انتقال ژن به سلولهای Cos-7 و 4 برابر در سلولهای HEK-293 کاراتر هستند. |
|
نانو ذرات پلیمری برای انتقال دارو به چشم |
انتقال نانوذرات ایجاد شده توسط پلیمرها برای دارورسانی به چشم به دو صورت نانوکره و نانوکپسول (نانوکپسول ساختار کیسهای است که دارو در حفره مرکزی با پلیمر احاطه میشود و نانوکره ماتریکسی از دارو و پلیمر به صورت همگن و یکدست میباشد). |
* انتخاب پلیمر بسته به میزان چربیدوستی داروها و توانایی ایجاد ذرات کوچک (حدود 100-200 نانومتر)، * ساخت نانوذرات قابل تزریق با روشهایی مانند تبخیر حلال (solvent evaporation) و یا خشک کردن افشانهای (spray drying)*هر چه اندازهی نانوذرات حاصل از این پلیمرها کوچکتر باشد، جذب آنها بهتر صورت میپذیرد. |
ارزیابی اثرات داروهای تزریقی استفاده شده به همراه پلیمر PLGA در حیوانات آزمایشگاهی |
|
آسیکلوویر[7] |
افزایش 13 برابری غلظت دارو در زلالیه |
|||
ونکومایسین[8] |
افزایش غلظت دارو در زلالیه تا 2 برابر |
|||
بودزوناید[9] |
ماندگاری دارو تا 14 روز و کنترل آزاد شدن تدریجی دارو در شبکیه |
|||
5-فلئورویوراسیل[10] |
ماندگاری دارو تا 7 روز، بدون ایجاد التهاب و سمیت |
|||
دارورسانی خوراکی |
به سبب قابلیت جذب بالای سلولهای پوششی روده، گاه میزان دارورسانی از این راه فراهمی زیستی بسیار کمی دارد که این امر میتواند ناشی از عدم پایداری ترکیب در دستگاه گوارش، نفوذناپذیری غشای گوارشی نسبت به ترکیب و یا ویژگیهای فیزیکوشیمیایی مادهی دارویی باشد. |
خاصیت غیرتهاجمی، مزیتهایی مانند جلوگیری از درد و ناراحتی و نگرانی از آلودگی همراه با تزریق را داراست، ایجاد پوششی محافظ توسط کپسولهکردن با پلیمرها میکند. خاصیت مخاطچسب برخی پلیمرها سبب افزایش اثربخشی دارو میگردد. |
بهینهسازی مخاطچسبی پلیمرها با بهینهسازی سطح،افزایش مخاطچسبی PLGA با تشکیل پیوند هیدروژنی، |
|
5- انواع داروهای کپسوله شده در نانوذرات PLGA
با توجه به خواص و زیستسازگاری مناسب PLGA از این پلیمر برای کپسوله کردن انواع داروها و مواد زیستی استفاده میشود. در جدول 2 به برخی از این موارد اشاره شده است.
جدول 2. برخی داروهای کپسوله شده با PLGA
دارو یا ماده زیستی کپسوله شده |
توضیحات و کاربرد |
مزایا |
پروتئینهای درمانی |
بالا بردن زیستسازگاری داروهای پروتئینی و افزایش اثربخشی و حمل آن به ناحیه هدف (شکل5) |
*غلبه بر مشکلات مصرف خوراکی پروتئینها*اتصال پروتئینها به ماتریکس پلیمری، سدی در مقابل تخریب آنزیمی و هیدرولیتیکی در محیط بدن |
هورمون |
تجویز استروئید به عنوان بخشی از هورمون درمانی برای علائم پس از یائسگی، کاهش خطر ابتلا به بیماری آلزایمر به واسطه ارتقاء رشد و بقای نورونهای کولینرژیک[11] و تهنشینی آمیلوئید مغزی به دلیل جذب استروئید و تاثیرگذاری بر ساختار اندامی همچون استخوان |
*رهاسازی متغیر استروئید کپسوله شده با تغییر در وزن مولکولی و ترکیب کوپلیمری PLGA در شرایط آزمایشگاهی و بدنی*کاهش رهاسازی دارو با افزایش وزن مولکولی و محتوای لاکتیدی PLGA*بهبود زیستدسترسپذیری دهانی و کاهش میزان دوزهای با استروئید بارگیری شده با نانوذرات PLGA و در نتیجه کاهش اثرات جانبی و افزایش رضایت بیمار |
داروی دگزامتازون |
تجویز دگزامتازون در مورد مننژیت باکتریایی قبل از تجویز آنتی بیوتیک، دارو پاسخ التهابی بدن به باکتری را که با مصرف آنتی بیوتیکها ایجاد میشود کاهش میدهد. دگزامتازون موجب جلوگیری از نفوذ لوکوسیتها به ناحیه عفونی میشود. این دارو، کممحلول و کریستالی است که برای معالجه ورم ماکولار دیابتی، به صورت ایمپلنت استفاده میشود. |
*کپسوله شدن دگزامتازون با روش تبخیر حلال درون نانوذرات PLGA*رهایش کامل دارو در شرایط آزمایشگاهی بعد از ۴ ساعت نهفتگی در دمای37oC از فرمولاسیون*بیشترین بارگیری با مقدار mg ١٠٠ در مخلوط استون- دی کلرو متان با نسبت حجمی (١:١) و mg ١٠ دگزامتازون |
داروی دیابت (انسولین) |
لزوم وجود چهار تزریق زیرپوستی انسولین در روز برای ایجاد سطح معمول گلوکز سرمتجویز موثر دهانی فرمولاسیون ویژه ۶/١ % زینک انسولین در PLGA با افزودنیهای الیگومر فوماریک انیدرید و اکسید آهن |
*توانایی کنترل سطح گلوکز پلاسما وقتی که با تجمع همزمان گلوکز مواجه شود*حفظ استحکام انسولین در حین فرمولاسیون و تحویل*بالاترین بازده کپسولاسیون (75%) هنگام تهیه نانوذرات با تکنیک تبخیر حلال |
داروی اعصاب و روان (هالوپریدول[12]) |
استفاده از داروی هالوپریدول علیه بیماریهای روان، برای معالجه اسکیزوفرنی و در حالتهای روانی حادفعالیت قوی علیه توهم و تصور عمدتا به دلیل انسداد گیرنده دوپامین در مزوکرتکس و سیستم لیمبیک[13] مغز، کپسوله و رهاسازی کنترل شده هالوپریدول با PLGA |
*تاثیر زیاد گروههای انتهایی PLGAبر راندمان تشکیل هالوپریدول و آزادسازی آن از نانوذرات*افزایش میزان راندمان الحاق دارو به نانوذرات PLGA (پوشیده شده) با گروههای انتهایی هیدروکسیلی، بیشتر از ٣٠% در حالی که همین میزان برای نانوذرات PLGA با گروههای انتهایی متیلی در حدود ١٠% است.* PLGA های پوشیده نشده رهاسازی اولیه انفجاری کمتر و دوره طولانیتری از رهاسازی هالوپریدول در مقایسه با PLGA پوشیده شده دارند. |
داروهای ضدسرطان |
بارگذاری بسیاری از داروهای ضدسرطان در درون PLGAکپسوله کردن داروهای مربوط به سرطان مانند پاکلیتاکسل[14]، دوکسوروبیسین[15]، ٥-فلئورواوراسیل، سیسپلاتین[16]، تریپترولین[17]، دگزامتازون و زانتون با نانوذرات PLGA |
*محافظت از داروهایی با انحلالپذیری ضعیف و ناپایدار در محیط بیولوژیکی*اندازه ریز ذرات سبب نفوذ در مویرگها و ورود به سلولها میشود.* قابلیت اصلاح سطح آنها برای تحویل هدفمند مولکولها به تومور یا سایر بافتها*کاربری چندگانه بودن PLGAهایی با منافذ بزرگتر برای تصویربرداری و آشکارسازی |
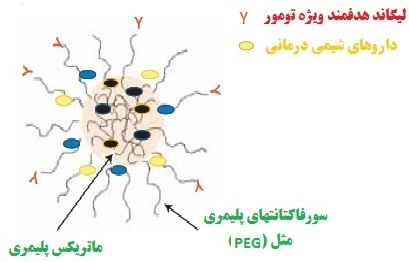
شکل5. شمایی از پلیمر حاوی لیگاندهای هدفمند بارگیری شده با دارو
6- واکسیناسیون با نانوذات پایه PLGA
آنتیژن[18]های زیادی به عنوان پروتئینها، پپتیدها، لیپوپپتیدها، ویروسها یا DNA پلاسمید در نانوذرات PLGA با موفقیت فرموله شدهاند. رهاسازی طولانی مدت آنتیژنها در واکسیناسیون، پاسخهای ایمنی بسیار موثری تولید میکند. نانوذرات PLGAمیتوانند در شرایط آزمایشگاه به طور پیوسته آنتیژنهای گیرافتاده را در مدت زمان طولانی رها کنند. این نانوذرات به عنوان سامانههای تحویلی میتوانند آنتیژن، ترکیبی از آنتیژنهای مختلف و یا مهمتر از سایرین، ترکیب آنتیژنها با مواد کمکی را در ذره یکسان، کپسوله کنند. گفته میشود که بایستی آنتیژنها و مواد کمکی در ذره یکسان و با هم تحویل داده شوند تا به طور همزمان به سلول یکسان وارد شوند. علاوه بر آن نانوذراتPLGA حاوی دوزهای بسیار کم آنتیژن و مواد کمکی، منجر به تولید پاسخهای قوی سلولهایT میشوند. مصرف پایین دوزهای این مولکولها نه تنها در کاهش اثرات جانبی تولید شده توسط مواد کمکی موثر است بلکه از دیدگاه اقتصادی هم حائز سودمندیهایی هستند و چندین آنتیژن و مواد کمکی میتوانند به طور موفقیتآمیزی در درون نانوذرات PLGA کپسوله شوند.
————————————————————-
[1]Photodynamic therapy (PDT)
[2]Photo Sensitizer (Ps)
[3]Hypericin
[4]Indomethacin Green (ICG)
[5]Magnetic nanoparticles (MNP)
[6]Oligonucleotide
[7]Acyclovir
[8]Vancomycin
[9]Budesonide
[10]5-fluorouracil
[11]Cholinergic
[12]Haloperidol
[13]Limbic
[14]Paclitaxel
[15]Doxorubicin
[16]Cisplatin
[17]Triptorelin
[18] Antigen Presenting Cells (APCs)
7- محصولات تولید شده با PLGA
در جدولهای 3 و 4 به محصولات دارویی تولید شده به کمک PLGA موجود در بازار اشاره شده است.
جدول 3. برخی داروهای تولید شده با PLGA برای رهایش طولانی مدت دارو (مورد تایید FDA)
| نام محصول | دارو | شرکت | دوز | کاربرد | |
| Risperdal Consta | Resperidone | Janssen
Alkermes |
1 mo | شیزوفرنی
دوقطبی |
|
| Sandostatin LAR | Octreotide | Novartis | 1 mo | آکرومگالی | |
| Zoladex | Goserelin | AstaZeneca | 1, 3 mo | سرطان پروستات | |
| Lupron Depot | Leuprolide | Takeda/
Abbott |
1, 3, 4, 6 mo | سرطان پروستات | |
| Decapeptyl/
Telstar/ Pamorelin |
Triptorelin | Ipsen/
Watson/ Reddy Debiopharm |
1 mo
3 mo 6 mo |
سرطان پروستات | |
| Profact Depot | Buserelin | Aventis | 2-3 mo | سرطان پروستات | |
| Bydureon | Exenatide | Amylin/BMS
Alkermes |
1 wk | دیابت نوع 2 | |
| Eligard | Leuprolide | QLT | 1, 3, 4, 6 mo | سرطان پروستات |
جدول 4. برخی کاربردهای PLGA
| نام محصول | ماده فعال | شرکت | کاربرد |
| Lupron Depot® | لوپرلاید استات[1] | TAP | سرطان پروستات |
| Nutropin Depot® | هورمون رشد[2] | Genetech | کمبود هورمون رشد در کودکان |
| Suprecur® MP | بوسرلین استات[3] | Aventis | سرطان پروستات |
| Decapeptyl® | Triptorelin pamoate | Ferring | سرطان پروستات |
| Sandostatin LAR® Depot | اکتروتاید استات[4] | Novartis | آکرومگالی |
| Somatuline® LA | Lanreotide | Ipsen | آکرومگالی |
| Trelstar™ Depot | Triptorelin pamoate | Pfizer | سرطان پروستات |
| Arestin® | مینوسیکلین[5] | Orapharma | بیماری پریودنتال |
| Risperidal® Consta™ | ریسپریدون[6] | Johnson & Johnson | آنتی سایکوتیک |
————————————————–
[1]Leuprolide acetate
[2]Growth hormone
[3]Buserelin acetate
[4]Octreotide acetate
[5]Minocycline
[6]Risperidone
8- وضعیت فناوری در ایران و جهان
مطالعـات و تحقیقـات زیـادی در این زمینـه در کشـور مـا و جهان صـورت پذیرفتـه اسـت. ایـن مطالعـات بـا هـدف ایجـاد و توسـعه فنـاوری نانـو و اصـلاح محصـولات نانـو در سـطوح مختلــف مــورد بررســی و کنــکاش قــرار گرفتــه اســت. از مجموعه فعالیتهای انجام شده، موارد زیر قابل اشاره هستند:
جدول 5. ثبت اختراعات جهانی PLGA
| عنوان اختراع | مخترع | نماینده | سال ثبت اختراع | شماره ثبت | کاربرد یا توضیحات |
| Drug delivery composition | Carr, Daniel B.
Wise, Donald L. |
New England Medical Hospitals, Inc. | 2005 | US 6913760 | استفاده از پلیمر برای انتقال دو دارو، داروی ضد درد و یک داروی بیهوشی در محل درد |
|
Polymeric-hydroxyapatite bone composite
|
Laurencin, Cato T.
Devin, Jessica |
Massachusetts Institute of Technology | 1998 | US 5766618 | ساخت ترکیب کامپوزیتی زیستتخریبپذیر برای ساخت ایمپلنت در پیوند استخوان |
| Bioerodible polymeric semi-interpenetrating network alloys for internal fixation devices and bone cements | Wise, Donald L.
Trantolo, Debra J. |
Cambridge Scientific, Inc. | 2002 | US 6486232 | ساخت یک شبکه پلیمری نفوذپذیر از پلیمرها برای ترمیم بافت استخوان با قابلیت مهاجرت سلولی |
| Medical guide tubes | Wang, Shu
Ramakrishna, Seeram |
Agency for Science, Technology and Research | 2006 | US 7135040 | استفاده از ترکیب پلیمرهای PLGA و کیتوسان به صورت الیاف برای بازسازی اعصاب موش |
| Methods for treating dental conditions using tissue scaffolds | Rutherford, Bruce
Somogyi, Christopher White, Clinton |
Dentigenix Inc. | 2007 | US 7309232 | تولید داربست برای بازسازی بافت دندان به صورت هیدروژل یا سیمان دندانی و دارای عامل ضدالتهاب |
| Light-activated adhesive composite, system, and methods of use thereof | Mcnally-heintzelman, Karen M.
Heintzelman, Douglas L. |
Rose-Hulman Institute of Technology | 2009 | US 7501133 | چسب کامپوزیتی فعال به نور برای کاربرد پزشکی و جراحی. کامپوزیت شامل چسب حساس به نور لیزر و یک داربست شامل ماده زیستسازگار و زیست تخریبپذیر |
| Intravenous infusion of curcumin and a calcium channel blocker | Helson, Lawrence | Signpath Pharma Inc. | 2014 | US 8747890 | ترکیب و روش برای درمان بیماریهای سیستمیک توسط تزریق داخل وریدی فرمولاسیون کورکومین سنتز شده که شامل مسدودکنندههای کانال کلسیم برای کاهش سلولهای قرمز خون همولیز ناشی از کورکومین |
| Ocular implant made by a double extrusion process | Shiah, Jane-guo
Bhagat, Rahul Blanda, Wendy M. |
Allergan, Inc. | 2014 | US 8778381 | ساخت یک ایمپلنت چشمی زیستتخریبپذیر برای قرار دادن در منطقه چشمی و روشی برای درمان مشکلات پزشکی چشم |
| Method of micro-encapsulation | Mandal, Tarun K.
Graves, Richard |
Xavier University of Louisiana | 2014 | US 8628701 | روشی برای آمادهسازی میکروکپسول PLGA |
| Hyaluronic acid modification product | Shimoboji, Tsuyoshi | Chugai Seiyaku Kabushiki Kaisya | 2008 | US 7456275 | ترکیب هیالورونیک اسید یا پلیمر PLGA برای درمان و بازسازی بیماریهای مفصلی |
| Composition and device for in vivo cartilage repair | Bittmann, Pedro
Atkinson, Brent Benedict, James J. |
Sulzer Innotec AG | 2003 | US 6582471 | ترکیب هدایتکنندههای استخوانی و غضروفی درون تاتوسفرهای PLGA |
| Method for controlled release of parathyroid hormone from encapsulated poly(lactic-glycolic)acid microspheres
|
Ho, Mei-ling
Wang, Gwo-jaw Chang, Je-ken |
Kaohsiung Medical University | 2014 | US 8865220 | تولید میکروسفیرهای شامل پلیپپتیدهای زیستی فعال با کاردکرد مشابه هورمون پاراتیروئید به همراه PLGA |
| Ophthalmic drug delivery system | Chauhan, Anuj
Gulsen, Derya |
University of Florida Research Foundation, Incorporated | 2012 | US 8273366 | تحویل داروهای چشمی از طریق نانوکپسول داخل لنزهای چشمی |
| Drug delivery composition and device
|
Shastri, Venkatram R.
Yue, Isaac Langer, Robert S. |
Massachusetts Institute of Technology | 2003 | US 6582717 | ترکیب دارو شامل یک کمپلکس از مواد پلیمری و عامل فعال زیستی برای تحویل زیر لثه دارو |
| Compositions and methods for making and using laminin nanofibers
|
Ogle, Roy Clinton
Neal, Rebekah A |
University of Virginia Patent Foundation | 2014 | US 8728817 | ساخت یک بیومواد از زیست پلیمرهای PLGA، PCL و PDO و استفاده در اشکال مختلفی چون نانوالیاف و داربستها |
| Prolonged release of GM-CSF
|
Gombotz, Wayne
Pettit, Dean Pankey, Susan |
Immunex Corporation | 2001 | US 6274175 | رهایش طولانی مدت GM-CSF با استفاده از ترکیبی از پلیمرهای زیستتخریبپذیر |
| Thermosensitive biodegradable hydrogels for sustained delivery of leptin | Shah, Subodh | Amgen Inc. | 2003 | US 6541033 | تولید هیدروژل حساس به دما برای رهایش مواد فعال زیستی مانند پلیپپتیدها |
| Antibiotic microspheres for treatment and prevention of osteomyelitis and enhancement of bone regrowth | Ambrose, Catherine G.
Clyburn, Terry A. Mikos, Antonio G. |
Wm. Marsh Rice University
Board of Regents of the Univeristy of Texas System |
2015 | US 8986737 | ساخت میکروسفیرها برای رهایش طولانی مدت آنتیبیوتیک برای جلوگیری از بروز عفونتهای استخوانی در محل جراحی ایمپلنتهای استخوان |
جدول 6. ثبت اختراعات داخلی PLGA
| عنوان اختراع | مخترع | نماینده قانونی | سال ثبت اختراع | شماره ثبت | کاربرد یا توضیحات |
| تهیه و بررسی خصوصیات نانو ذرات کنژوگه HSA – PLGA نشان دار شده با ماده فلورسئین ایزوتیوسیانات FITC)) جهت هدفمند کردن انتقال دارو به بافت و تومور سرطانی ، تشخیص زودهنگام سرطان، عکس برداری از بافت سرطانی و تغییرات مربوط به آن در طی درمان | رسول دیناروند
بهراد درویشی سعید منوچهری |
– | 1394 | 79425 | کانزوگه آلبومین به همراه PLGA اتصال دارو و تشکیل نانو ذرات برای انتقال به بافت سرطان |
| داربست های نانو لیفی بر پایه ژلاتین با عملکرد هموستاتیکی برای کاربرد به عنوان پوشش زخم | هنا حنایی اهواز
مسعود سلیمانی |
شرکت بنیاخته | 1394 | 80443 | تولید داربست ژلاتین و PLGA از طریق الکتروریسی برای ترمیم ضایعات پوستی |
| داربست های نانو لیفی هیبریدی حاوی فاکتور رشد اپیدرمی برای کاربرد در مهندسی بافت پوست | ایمان شعبانی | – | 1394 | 81640 | تهیه داربستهای ترکیبی ژلاتین و PLGA حاوی فاکتور رشد اپیدرمی به روش الکتروریسی برای ترمیم ضایعات پوستی |
| طراحی و تولید داربست نانولیفی سه بعدی با ساختار پوسته- مغزی جهت ترمیم نخاع | محمد امانیتهرانی
مسعود لطیفی فاطمه زمانی |
– | 1394 | 81179 | تهیه داربستهای سه بعدی به روش الکتروریسی با ساختار پوسته – مغزی برای ترمیم ضایعات نخاعی (CNS) |
| نانو الیاف کپسوله کننده پروتئین جهت استفاده در کاربرد های مهندسی بافت | محمد نوروزی | شرکت بنیاخته | 1394 | 80469 | تهیه داربستهای PLGA حاوی سرم آلبومین گاوی از طریق فرآیند الکتروریسی امولسیون |
جدول 7. وضعیت فناوری PLGA در ایران (مقالات ISIچاپ شده در این زمینه)
موضوع پژوهش |
مرکز تحقیقاتی |
مجله |
توضیحات |
Preparation and mechanical behavior of PLGA/nano-BCP composite scaffolds during in-vitro degradation for bone tissue engineering |
دانشگاه صنعتی اصفهان دانشگاه علوم پزشکی اصفهان |
Polymer Degradation and Stability |
بررسی خواص داربست کامپوزیتی PLGA/nBCP برای مهندسی بافت استخوان |
Antibacterial activity of clarithromycin loaded PLGA nanoparticles |
دانشگاه علوم پزشکی تبریز |
Pharmazie |
سیستم دارورسانی شامل داروی آنتیبیوتیک کلاریترومایسین لود شده در نانوذرات PLGA |
Monodispersed Polymeric Nanoparticles Fabrication by Electrospray Atomization |
دانشگاه صنعتی شریفدانشگاه علوم پزشکی اصفهان |
INTERNATIONAL JOURNAL OF POLYMERIC MATERIALS AND POLYMERIC BIOMATERIALS |
ساخت نانوذرات پلیمری منو دیسپرس توسط اتمیزه الکترواسپری |
Improved drug loading and antibacterial activity of minocycline-loaded PLGA nanoparticles prepared by solid/oil/water ion pairing method |
دانشگاه علوم پزشکی تهران |
International Journal of Nanomedicine |
تولید نانوذرات PLGA حاوی داروی مینوسیکلین مناسب برای عفونتهای پریودنتال |
Preparation and in vitro evaluation of doxorubicin-loaded Fe3O4 magnetic nanoparticles modified with biocompatible copolymers |
دانشگاه علوم پزشکی تبریز |
International Journal of Nanomedicine |
استفاده از نانوذرات مغناطیسی آهن برای تحویل دارو، تصویر برداری و درمان و کپسوله کردن آن با ذرات PLGA-PEG |
The Effect of Topography on Differentiation Fates of Matrigel-Coated Mouse Embryonic Stem Cells Cultured on PLGA Nanofibrous Scaffolds |
پژوهشگاه مهندسی ژنتیکشرکت بنیاخته |
Tissue Engineering: part A |
بررسی تمایز سلولهای بنیادی به سه لایهی جنینی بر روی داربستهای PLGA |
Self-assembled nanomicelles using PLGA–PEG amphiphilic block copolymer for insulin delivery: a physicochemical investigation and determination of CMC values |
پژوهشگاه پلیمر و پتروشیمی |
Journal of Materials Science: Materials in Medicine |
ساخت نانومسیلهای خودمونتاژ PLGA-PEG برای انتقال انسولین |
Synthesis and characterization of pH-responsive and folated nanoparticles based on self-assembled brush-like PLGA/PEG/AEMA copolymer with targeted cancer therapy properties: A comprehensive kinetic study |
دانشگاه تهران |
European Journal of Medicinal Chemistry |
ساخت کوپلیمر PLGA / PEG / AEMAحساس به pH برای درمان سرطان |
جدول 8. وضعیت تحقیقات فناوری PLGA در ایران
موضوع پژوهش |
مرکز تحقیقاتی |
توضیحات |
ارزیابی تاثیر سلول های اندوتلیال، سلول های بنیادی اندومتریال و فاکتورهای آنژیوژنیک بر فعالیت سلول های استئوبلاست رشد یافته بر روی نانوساختار Silk/PLGA |
دانشگاه علوم پزشکی تهران |
ساخت داربست به روش انجماد خشک و الکتروریسی به همراه رهایش کنترل شده فاکتورهای آنژیوژنیک PDGF و VEGF برای رگزایی برای ترمیم بافت استخوان |
ساخت داربست نانولیفی پلی لاکتیک کو گلایکولیک اسید /کیتوسان و بررسی زیست سازگاری، تکثیر و تمایز سلول های بنیادی بالغ بر روی آن |
دانشگاه صنعتی اصفهان |
ساخت داربست نانوالیف PLGA – کیتوسان به روش الکتروریسی |
تهیه و ارزیابی برونتن تجمعات نانو ذرات PLGA حاوی داروی آزیترومایسین به منظور تهیه سامانه نوین DPI |
دانشگاه علوم پزشکی شهید بهشتی |
انتقال داروی آزیترومایسین از طریق ریه (استنشاق) توسط حاملهای نانوذرات پلیمری PLGA برای کاهش اثرات جانبی |
تهیه و بررسی خصوصیات نانوذرات کونژوگه PLGA(PLA)-HSA برای دارورسانی عوامل ضد سرطان |
دانشگاه علوم پزشکی تهران |
افزایش سمیت و اثربخشی نوذرات PLGA کونژوگه با آلبومین |
بررسی برون تن سمیت سلولی 9-نیتروکمپتوتسین در حامل نانوذرات PLGA-PEG با درصدهای مختلف PEG در مقایسه با نانوذرات PLGA حاوی دارو |
دانشگاه علوم پزشکی کرمانشاه |
افزایش فعالیت و اثربخشی 9- نیتروکمپتوتسین آلکالویید طبیعی استخراج شده از گیاه که آنتی توموری بالایی علیه سرطان پیشرفته پانکراس، تخمدان و لوکمی است با استفاده از کپسوله کردن در PLGA برای محافظت در برابر pH |
طراحی و ساخت داربست نانوکامپوزیتی PLGA/کیتوزان و ارزیابی تمایز سلولهای بنیادی مزانشیمی بر روی آن جهت مهندسی بافت عصب |
دانشگاه صنعتی اصفهان دانشکده مهندسی مواد |
تهیه داربست مهندسی بافت نانوبیوکامپوزیتی PLGA/CSبه روش الکتروریسی و بررسی تمایز سلولهای بنیادی استخراج شده از چربی به بافت عصبی |
ساخت و بررسی نانوسفرهای حساس به دمای PLGA-PEG-PLGA حاوی انسولین و بررسی الگوی رهش دارو در برونتن |
دانشگاه علوم پزشکی مشهد |
کوپلیمرتری بلاک PLGA-PEG-PLGA از دسته پلیمرهای حساس به دمای ژل شونده در محل استفاده شده برای رهایش انسولین |
9- چالشهای نانوذرات PLGA
نانوذرات باید توان کپسوله کردن بالا (توان کپسولهکردن = میزان درصد داروی کپسوله شده توسط پلیمر به مقدار کل داروی استفاده شده برای فرمولاسیون در ابتدای فرآیند ساخت) و توان زیاد در بارگیری دارو (توان بارگیری = میزان درصد داروی بارگیری شده نسبت به مقدار کل نانوذرات دارا و بدون دارو) داشته باشند. تخمین دقیق ظرفیت دارو آسان نیست چون نانوذرات سیستمی کلوئیدی دارند. بنابراین بیشترین روش مطرح شده برای جداسازی نانوذرات از داروهای کپسوله نشده یا جذب نشده، اولتراسانتریفیوژ است. بازده کپسوله کردن داروها از ٦% تا ٩٠% برای دگزامتازون و پاکلیتاکسل متغیر است.
از چالشهای عمده نانوذرات پایه PLGA، بارگیری ضعیف آنها است (در حدود %١، یعنی نانوذرات حاوی 1mg از جزء ترکیبی فعال در 100mg نانوذرات پلیمری هستند). بارگیری ضعیف مشکلاتی را برای برخی از داروها در طرحهای نانوذرات پایه PLGA ایجاد میکند. چالش مهم دیگر، رهاسازی انفجاری دارو است که برای اغلب نانوذرات پایه PLGA مطرح میشود. لذا احتمال نرسیدن دارو به بافت یا سلولهای هدف وجود دارد که باعث کاهش راندمان میشود.
10- پيش بيني و نماي كلي بازار
طبق گزارش انجام شده توسط Dewan، حجم بازار جهانی ترکیبات پلیمری در سال 2013 حدود 9 میلیارد دلار بوده است ( جدول 9). بیشترین حجم بازار در این سال مربوط به بخش نانوذرات با بازار جهانی حدود 53 میلیارد دلار بوده است. در سال 2011، حجم کل بازار جهانی دارورسانی هدفمند 92.1 میلیارد دلار بوده است. انتظار میرود این بازار در سال 2018 با رشد 2.4 درصدی به رقم 109 میلیارد دلار برسد. اين موضوع ناشي از ميزان هزينههاي بالايي است كه صرف تحقيق و توسعه وابسته به نانوفناوري در صنايع داروسازي و بخش سلامت ميشود. توسعه بازار نانوساختارها به واسطه پیشرفت داروهای نانوفناوری در سرطان است، که اثرات جانبی را به طور موثری کاهش میدهد (Dewan, 2014).
جدول 9. بازده جهانی سامانه رهایش دارو به واسطه ترکیبات پلیمری، تا سال 2018 (میلیون دلار)
| CAGR%
2018-2013 |
2018 | 2013 | 2012 | 2011 | سیستم |
| 4.2 | 11,035.2 | 8,995.0 | 8,573.4 | 8,254.6 | ترکیبات پلیمری |
11- بحث و نتیجه گیری
نانوذرات PLGAحائز منافع زیادی در دارورسانی هستند. این نانوذرات میتوانند داروها را از تخریب محافظت کرده و سبب افزایش پایداری آنها گردند. در این گزارش به معرفی PLGA پرداخته شده و نحوه ورود آن به بدن، چالشهای موجود و شیوههای حمل مولکولهای زیستی مختلف، محصولات موجود در صنعت دارویی و تحقیقات انجام شده داخلی و خارجی به صورت مختصر مورد بررسی قرار گرفت.
—————————————
منابـــــع :
- Danhier, F., Ansorena, E., Silva, J-M., Coco, R., Breton, A-L., Preat, V., “PLGA-based nanoparticles: An overview of biomedical applications”, Journal of Controlled Release, Vol, 161., pp, 505–522, (2012)
- Kumari, A, Yadav, S. K., Yadav, S. C., “Biodegradable polymeric nanoparticles based drug delivery systems”., Colloids and Surfaces B: Biointerfaces,Vol, 75.,pp, 1–18., 2010
- R, Pintoeis, C., et al., ”Nanoencapsulation I. Methods for preparation of drug-loaded polymeric nanoparticles. Nanomedicine: Nanotechnology”, Biology and Medicine, Vol, 2(1),pp, 8-21., 2006
- Shalini Shahani Dewan, January 2014. PHM006J – Global Markets and Technologies for Advanced Drug Delivery Systems. Bcc Research GLOBAL MARKETS AND TECHNOLOG
- H., Suh, et al., ”Nanotechnology, nanotoxicology, and neuroscience”., Progress in Neurobiology, Vol, 87(3),pp, 133-170., 2009
—————————————
محمد وزیرزاده
کارگروه صنعت و بازار
ترویج صنعتی فناوری های نانو و میکرو
=====================================================================================================================
برای دسترسی به فایل PDF کلیه گزارشات، به بخش گزارش های صنعتی پایگاه اینترنتی نانو و صنعت (www.INDnano.ir/category/report) مراجعه نمایید.
=====================================================================================================================